(1)从海水中提取食盐的方法主要为盐田法,这是一种古老而至今仍广泛沿用的方法。海水晒盐的流程如下:
海水晒盐后得到的母液是当时温度下氯化钠的 溶液(填“饱和”或“不饱和”)。
(2)下图是A、B两种物质的溶解度曲线,回答下列问题:
①t2℃时,A的饱和溶液中溶质的质量分数为 。
②将A和B的饱和溶液,由t2℃降温到t1℃时(假设溶剂质量不变),判断它们溶液中溶质的质量分数如何变化?简要写出理由。_________________________
根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 |
0 |
20 |
40 |
60 |
80 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。
(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。

(4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。
常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
如图是MgCl 2、KCl和MgSO 4的溶解度曲线。下列说法错误的是( )

| A. |
P点表示t 2℃时KCl和MgSO 4的溶解度相等 |
| B. |
t 1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl 2 |
| C. |
将t 2℃时的三种物质的饱和溶液分别升温至t 3℃,会析出晶体的是MgSO 4 |
| D. |
t 2℃时,将40g MgCl 2加入50g水中充分搅拌,所得溶液质量为90g |
根据表中NaCl和KNO3部分溶解度数据分析,回答下列问题:
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
(1)30℃时,NaCl的溶解度是 g.
(2)NaCl与KNO3相比较,溶解度受温度变化影响较小的物质是 .
(3)20℃时,在100g水中加入50gNaCl或50gKNO3,充分搅拌后,将溶液温度升高到40℃(不考虑水分蒸发),所得溶液是不饱和溶液,则加入的物质是 .
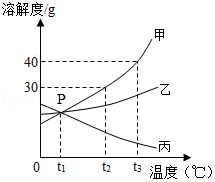
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示在温度为t1℃时,三种物质的溶解度 。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是 (任写一种)。
(3)t2℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度后,所得溶液的质量是 g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为 。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
如图是甲、乙两种物质的溶解度曲线,以下说法正确的是( )

A.15℃时,甲物质溶液中溶质的质量分数一定等于乙物质溶液中溶质的质量分数
B.15℃时,甲物质饱和溶液和乙物质饱和溶液中溶质与溶剂的质量比为1:5
C.30℃时,甲物质的饱和溶液和乙物质的饱和溶液降温至15℃时均是饱和溶液
D.30℃时,甲物质溶液中溶质的质量分数一定小于乙物质溶液中溶质的质量分数
相关说法正确的是
| A.氧化反应就是物质与氧气发生的反应 |
| B.摩尔质量就是式量 |
| C.氧化物就是由两种元素组成的含氧化合物 |
| D.饱和溶液就是不能再溶解物质的溶液 |
下列关于溶液的叙述正确的是
| A.溶液中只有一种溶质时,溶液为纯净物 |
| B.溶液中各部分性质相同 |
| C.饱和溶液一定比不饱和溶液浓 |
| D.硝酸铵固体溶于水形成溶液时仅发生扩散吸热的过程 |
如图是3种物质的溶解度曲线,下列叙述正确的是( )

A.0℃时,NaCl的溶解度小于NH4Cl的溶解度
B.40℃时,饱和Na2CO3溶液的溶质度量分数为49%
C.将饱和Na2CO3溶液由80℃冷却至40℃时,有固体析出
D.80℃时,分别将等质量的NH4Cl和NaCl固体溶于适量的水,恰好均配成饱和溶液,所得溶液的质量前者小于后者
右图是甲、乙两种物质(不含结晶水)的溶解度曲线。下列说法中不正确的是
| A.t1℃时,50g甲的饱和溶液中有15g甲 |
| B.t2℃时,等质量的甲、乙的饱和溶液降温到 t1℃,所得的溶液中甲的质量小于乙的质量 |
| C.要使甲的饱和溶液变为不饱和溶液,可采用升高温度的方法 |
| D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲 |
一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
| 物质 |
A |
B |
C |
D |
| 反应前质量/g |
1.7 |
2.2 |
7.9 |
0.9 |
| 反应后质量/g |
待测 |
6.6 |
0 |
2.7 |
则反应后A的质量为 ;该反应所属的基本反应类型是 ;该反应中B和D两种物质变化的质量比为 。
下列对溶液的叙述,不正确的是
| A.无色透明的液体一定是溶液 |
| B.水是常见的溶剂 |
| C.溶液中可能有多种溶质 |
| D.饱和溶液降温后,不一定有晶体析出 |
甲、乙、丙三种物质的溶解度曲线如图所示,请回答。
(1)P点的含义是 。
(2)气体的溶解度随温度变化的趋势与 (填“甲”、“乙”或“丙”)相似。
(3)t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为 g。
(4)若乙中含有少量甲,提纯乙的方法是 。
(5)将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,对所得溶液的分析正确的是 (填字母序号)。
A.溶解度:乙>甲>丙
B.溶剂质量:丙>乙>甲
C.溶液质量:乙>甲>丙
D.溶质质量分数:乙>甲>丙

如图是三种常见固体物质的溶解度曲线。回答下列问题:

(1)KNO3的溶解度随温度升高的变化趋势是 (填“逐渐增大”或“逐渐减小”)。
(2)实验室配制溶液有如下步骤:(已知20℃时KCl的溶解度是34g)
①计算:20℃时,将67g的KCl饱和溶液稀释为20%,需加水18g。
②量取: 用量简量取水倒入烧杯中,提供的量筒规格有10mL、20mL、50mL,应该选择 mL的量筒。
③混匀:用 搅拌,使溶液混合均匀。
(3)根据以上溶解度曲线,判断下列说法正确的是 (多选)。
A.40℃时,KNO3的溶解度是64g,表示100g KNO3饱和溶液中含64g KNO3
B.Ca(OH)2的溶解度受温度变化的影响小于KCl的溶解度受温度变化的影响
C.KNO3混有少量KCl时,可用降温结晶法提纯
D.60℃时,将等质量的KNO3、KCl两种物质分别配制成饱和溶液,KNO3需要水的质量大于KCl
试题篮
()