硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )

| A. |
操作I一定是降温 |
B. |
①与②的溶液质量一定相等 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
KNO3、NaNO3、NaCl三种物质的溶解度曲线如图所示,下列说法正确的是( )

A.KNO3的溶解度比NaCl大
B.将KNO3饱和溶液降温,溶液中KNO3的质量分数不变
C.KNO3饱和溶液中含少量NaCl,可通过降温结晶的方法提纯
D.将100g 40℃的NaNO3饱和溶液降温至0℃,析出31g晶体
请认真阅读材料,回答下列有关问题。
能源问题是困扰人类可持续发展的一个重要因素。能源的开采、开发、储存和综合利用是目前世界各国科学家研究的重大课题。
(1)人类目前使用的化石燃料有煤、天然气和。
(2)天然气是常见的燃料,写出其燃烧的化学方程式:。
(3)我国是世界产煤大国。但含硫煤燃烧排放的二氧化硫,会引起"酸雨"。为减少大气污染,某发电厂采用了"石灰固硫法",即在一定条件下向煤中掺入生石灰,用来吸收二氧化硫,已知这一过程中,各元素的化合价均未发生改变,写出"石灰固硫法"的化学方程式。
(4)科学家预言,氢能将成为
世纪的主要能源,试从氢气的性质分析氢气作为能源的主要优点:。
(5)如图所示是甲、乙两种物质(不含结晶水)的溶解度曲线。

①下列有关说法正确的是()
| A. | 时,甲、乙溶液中溶质的质量分数一定相等 |
| B. | 时,甲的溶解度为 |
| C. | 时,甲、乙的饱和溶液分别恒温蒸发相同的水,甲析出的晶体的质量比乙多 |
| D. | 甲的溶解度大于乙的溶解度 |
②将
甲物质的不饱和溶液变成饱和溶液,可采取方法。
(6)如图所示都是常见的日常生活用品,其中是有机高分子材料的有:(填序号)。生活中要鉴别羊毛衫和合成纤维,可通过的方法。

甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述中错误的是
| A.t2℃时甲的溶解度比乙的大 |
| B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 |
| C.升高温度可将甲的饱和溶液变成不饱和溶液 |
| D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 |
甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是()

| A. | ℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 |
| B. | ℃时,甲、乙饱和溶液的溶质质量分数都为30% |
| C. | ℃时,甲、乙的饱和溶液分别降温至 ℃,甲溶液饱和,乙溶液不饱和 |
| D. | ℃时,质量相同的甲、乙饱和溶液分别升温至 ℃,为达饱和状态,需加入甲的质量大于乙 |
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
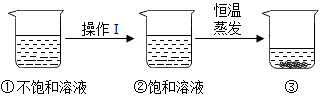
| A. |
操作Ⅰ一定是降温 |
B. |
操作Ⅰ一定是加溶质 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
溶液在生活、生产中具有广泛的用途。
(1)在20℃时,将20g氯化钾固体加入50g水中,充分搅拌后,仍有3g氯化钾固体未溶解。所得溶液中氯化钾的质量分数为 (计算结果保留一位小数);20℃时氯化钾的溶解度为 。
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图。t1℃时,甲溶液的溶质质量分数与乙溶液的溶质质量分数相比,前者与后者的关系是 (填字母)。
A.大于 B.小于 C.等于 D.无法确定
(3)如图是实验室稀释浓硫酸的正确和错误操作,请说明不能将水直接倒入浓硫酸中进行稀释的原因 。


下列关于溶液的叙述正确的是
| A.溶液中只有一种溶质时,溶液为纯净物 |
| B.溶液中各部分性质相同 |
| C.饱和溶液一定比不饱和溶液浓 |
| D.硝酸铵固体溶于水形成溶液时仅发生扩散吸热的过程 |
如图是3种物质的溶解度曲线,下列叙述正确的是( )

A.0℃时,NaCl的溶解度小于NH4Cl的溶解度
B.40℃时,饱和Na2CO3溶液的溶质度量分数为49%
C.将饱和Na2CO3溶液由80℃冷却至40℃时,有固体析出
D.80℃时,分别将等质量的NH4Cl和NaCl固体溶于适量的水,恰好均配成饱和溶液,所得溶液的质量前者小于后者
右图是甲、乙两种物质(不含结晶水)的溶解度曲线。下列说法中不正确的是
| A.t1℃时,50g甲的饱和溶液中有15g甲 |
| B.t2℃时,等质量的甲、乙的饱和溶液降温到 t1℃,所得的溶液中甲的质量小于乙的质量 |
| C.要使甲的饱和溶液变为不饱和溶液,可采用升高温度的方法 |
| D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲 |
许多在水溶液中的反应(如复分解反应),往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度。
| 物质 |
AgCl(白) |
Ag2S(黑) |
CaCO3(白) |
CaSO4(白) |
| 溶解度/g |
 |
 |
 |
0.2 |
(1)写出CaSO4转化为CaCO3的化学方程式:_________________。若在有氯化银固体的水中加入硫化钠溶液,可能发生的反应现象是__________;反应方程式是______________________________。
(2)生成硫酸铵化肥的方法之一是把石膏粉(CaSO4)悬浮于水中,不断通入氨气并再通入二氧化碳,充分反应后,立即过滤,滤液经蒸发而得到硫酸铵晶体。反应的化学方程式为 ,其中x是__________,y是__________。
,其中x是__________,y是__________。
(3)CaCl2溶液和NaHCO3溶液反应生成CaCO3沉淀。为表示这个反应写出了下列两个反应方程式:①
②
你认为哪一个反应的化学方程式不合理,并简述理由:____________________。
下图为甲﹑乙两物质的溶解度曲线。下列说法不正确的是
| A.甲的溶解度受温度影响比乙大 |
| B.t1 ℃时,甲、乙两物质饱和溶液中溶质的质量分数相同 |
| C.t2 ℃时,N点的甲溶液为饱和溶液 |
| D.宜采用蒸发溶剂的方法得到乙晶体 |
甲、乙、丙三种物质的溶解度曲线如图所示,请回答。
(1)P点的含义是 。
(2)气体的溶解度随温度变化的趋势与 (填“甲”、“乙”或“丙”)相似。
(3)t3℃时,将40g甲物质加到50g水中充分溶解后,所得溶液的质量为 g。
(4)若乙中含有少量甲,提纯乙的方法是 。
(5)将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,对所得溶液的分析正确的是 (填字母序号)。
A.溶解度:乙>甲>丙
B.溶剂质量:丙>乙>甲
C.溶液质量:乙>甲>丙
D.溶质质量分数:乙>甲>丙

如图是三种常见固体物质的溶解度曲线。回答下列问题:

(1)KNO3的溶解度随温度升高的变化趋势是 (填“逐渐增大”或“逐渐减小”)。
(2)实验室配制溶液有如下步骤:(已知20℃时KCl的溶解度是34g)
①计算:20℃时,将67g的KCl饱和溶液稀释为20%,需加水18g。
②量取: 用量简量取水倒入烧杯中,提供的量筒规格有10mL、20mL、50mL,应该选择 mL的量筒。
③混匀:用 搅拌,使溶液混合均匀。
(3)根据以上溶解度曲线,判断下列说法正确的是 (多选)。
A.40℃时,KNO3的溶解度是64g,表示100g KNO3饱和溶液中含64g KNO3
B.Ca(OH)2的溶解度受温度变化的影响小于KCl的溶解度受温度变化的影响
C.KNO3混有少量KCl时,可用降温结晶法提纯
D.60℃时,将等质量的KNO3、KCl两种物质分别配制成饱和溶液,KNO3需要水的质量大于KCl
试题篮
()