(7分)菱镁矿的主要成分是
,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的
溶液,生成的气体全部用
溶液吸收,
溶液增加的质量记录如下表:
| 加入
溶液的质量/g |
50 |
100 |
150 |
200 |
|
溶液增加的质量/g |
2.2 |
4.4 |
4.4 |
4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。.
(1)10g菱镁矿与
溶液完全反应,生成
的质量为。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)

(3)该实验研究中所用
溶液的溶质的质量分数是。
(4)为避免溶液排放对环境的影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了l.71%的
溶液。请你画出加入
溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
将18g高锰酸钾加热,当产生1.6g氧气时,固体剩余物是 ( )
| A. | B. | ||
| C. | D. |
在一个密闭容器内有如下反应,反应前后测得各物质的质量如下表所示:
| 物质 |
||||
| 反应前的质量/ | 40 |
4 |
3.6 |
4.8 |
| 反应后的质量/ | 待测 |
13 |
12.6 |
10.8 |
下列说法正确的是 ( )
| A. |
该反应为化合反应 |
B. |
反应生成的 和 的质量比为 |
| C. |
待测值为16 |
D. |
和 的相对分子质量之比为 |
三位同学分别用相同质量分数的稀盐酸,测定某石灰石样品中碳酸钙的质量分数(石灰石中的杂质既不与酸反应,也不溶于水)。
(1)小敏的方法可用如下流程表示,测得的碳酸钙的质量分数为;在过滤操作中,需要用到的玻璃仪器有(选填序号)。
A.酒精灯、漏斗、玻璃棒 B. 漏斗、玻璃棒、烧杯 C. 酒精灯、试管、玻璃棒

(2)小华取10克样品,用如图甲实验装置进行实验,反应结束后,测得B装置质量增加了4.6克,根据上述数据,算得碳酸钙的质量分数,发现与事实严重不符,造成这种情况的可能原因是。
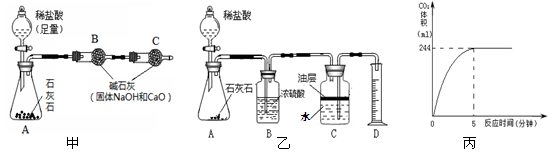
(3)小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙。已知本实验条件下CO2的密度为1.8克/升,求该石灰石样品中CaCO3的质量分数。
(4)求实验所用的稀盐酸溶质质量分数。
今年我国"世界环境日"的主题是"向污染宣战"。某化工厂排放的废水中含有氢氧化钾和碳酸钾。现取50g废水样品于锥形瓶中,逐渐加入20%的稀硫酸,到恰好完全反应时,共滴加稀硫酸98g,同时收集到2.2g二氧化碳。求废水样品中氢氧化钾的质量。
在托盘天平两边各放一只烧杯,调节至平衡。在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A。有气体产生时,天平指针慢慢向左偏转(如图1);指针偏转到一定角度后,又慢慢向右偏转;反应结束,天平指针指向右端(如图2)。则天平右端加入的金属A可能是( )
A.Zn B.Mg C.Cu D.Al
如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是( )
| A.X表示反应所用时间,Y表示生成氢气的质量 |
| B.X表示生成氢气的质量,Y表示反应所用时间 |
| C.X表示滴加稀硫酸的质量,Y表示生成氢气的质量 |
| D.X表示参加反应的金属的质量,Y表示生成氢气的质量 |
甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2 mCO2+2CO+16H2O。若反应生成3.6g水,请计算:
mCO2+2CO+16H2O。若反应生成3.6g水,请计算:
⑴m值是__________。
⑵参加反应的氧气质量是多少克?
同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。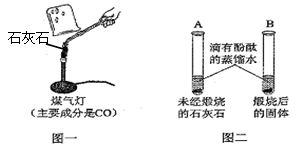
II.乙同学按图二所示进行试验,观察到B中液体变 色,A实验的作用 。
III.丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算:丙所取的这块石灰石中碳酸钙的质量分数是多少?
计算过程写在答卷上
下图A、B、C是实验室制备某些常见气体的发生装置示意图。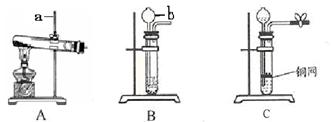
(1)写出图中标号仪器的名称:
a , b 。
(2)A可用作实验室制取氧气的化学方程式是 。
(3)B可用作实验室制取二氧化碳的化学方程式是 。
(4)下列装置可用来进行“排空气法”收集H2的是 (填序号)。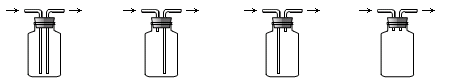
A. B. C. D.
(5)某同学在装置B的基础上,增加了隔离铜网和止水夹等改成装置C来制取二氧化碳,装置C与B相比,突出优点是 。
(6)取石灰石与稀盐酸充分反应后的溶液A, 向其逐滴加入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下(pH为纵坐标,时间为横坐标)。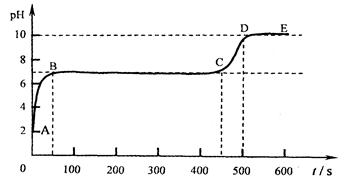
①写出BC段相关的化学方程式是 。
②CD段上升的原因是 。
③小红取溶液A50 g,逐滴加入某质量分数的碳酸钠溶液。他根据实验测得的数据绘出下图,其中纵坐标m是实验得到的沉淀的质量,横坐标表示的是碳酸钠溶液质量。由图像回答下列问题: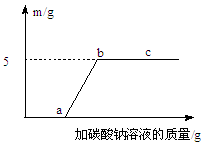
(Ⅰ)原废液中含氯化钙的质量为 g。
(Ⅱ)C点时的溶液中溶质含 。(填化学式)
混有某种物质的碳酸钙100g与足量的稀盐酸反应后,放出45g二氧化碳气体,则混入的物质可能是
| A.K2CO3 | B.NaOH | C.Na2CO3 | D.MgCO3 |
有NaOH和Na2CO3的混合物9.3g,为测定其中NaOH的质量,将混合物溶于一定量的水中后,再向其中加入200g稀硫酸时恰好使Na2CO3完全转化为CO2,产生的CO2气体共2.2g。
(1)求混合物中NaOH的质量是多少?
(2)若要求出反应后溶液中硫酸钠的质量分数,题中还缺少一个原始数据m(单位为:g),请问m表示什么?
(3)请用含m的代数式表示反应后溶液中硫酸钠的质量分数。
日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金。
(1)赤铜(
)是我国古代制取黄铜的一种原料。
中铜元素与氧元素的质量比是。
(2)用来制造弹壳的黄铜只含有锌和铜。将22
弹壳放在盛有100
稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121.8
。计算:
①产生氢气的质量。
②弹壳中铜的质量。
③反应后所得溶液中
的质量分数(计算结果保留一位小数)。
实验后的废液一般需回收处理,不能直接倒入排污管。小科实验后收集到含有碳酸钠和氧氧化钠的混合废液10.22
,他向废液中缓缓滴入溶质质量分数为19.6%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示。当废液恰好处理完毕时,溶液总质量为20
。溶于水的气体忽略不计,则

(1)废液恰好处理完毕时.溶液的
为。
(2)图中
。
(3)废液恰好处理完毕时,回收所得溶液的溶质质量分数是多少?
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定。
实验设计:
甲组:取纯净碳酸钙粉末
于烧杯中,加入
该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体
。
乙组:取纯净碳酸钙粉末
于锥形瓶中,将
该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装置示意图如下:
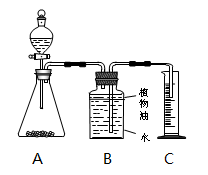
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数。(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是
试题篮
()