黄铜主要是由铜和锌组成的铜锌合金,它强度高,可塑性好,易加工,耐腐蚀。使用范围广。化学实验小组的同学想知道某种黄铜中铜和锌的含量,他们将100g黄铜磨成粉沫,然后放入盛有足量稀盐酸的烧杯中,反应生成氢气的量与时间的关系如图。
试回答:
(1)反应前将黄铜打磨成粉沫的目的是 。
(2) 该黄铜中铜和锌的质量分数是多少。
(3)若该黄铜中还含有锡(Sn)、铅(Pb)等金属,对计算结果中铜的含量造成的影响是 (填“偏高”或“偏低”)
4分)某化学小组同学欲测定铜锌合金中铜元素的质量分数。
(1)甲方案:取10g合金粉末,加入少量稀硫酸后,收集到0.1g氢气,计算合金中铜元素的质量分数为62.5%。老师指出其测定结果不准确,原因是 。
(2)乙方案:取10g合金粉末,加入足量硫酸铜溶液,充分反应后,过滤,洗涤,烘干,测得固体质量为9.9g。计算合金中铜元素的质量分数。
整理实验室时,同学们发现一瓶盐酸呈黄色,老师解释说里面含有氯化铁。为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小明做了如下实验:取20g工业盐酸加适量的水稀释后加入小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时不断测量溶液的pH,得出如图所示的关系(横坐标x表示滴加氢氧化钠溶液的质量)。则下列分析错误的是
| A.工业盐酸呈黄色是因为含有Fe3+ |
| B.点A时溶液中所含溶质是NaCl和FeCl3 |
| C.当16<x≤22时的实验现象是有红褐色沉淀产生 |
| D.当x =22g时,所得沉淀为19.6g |
将一氧化碳通入盛有12克的氧化铁的试管内,加热反应一段时间后,停止加热,继续通入一氧化碳至试管冷却,此时试管内残留的质量为9.6克,下列说法正确的是
| A.生成铁的质量是9.6g | B.生成二氧化碳的质量为9.9g |
| C.参加反应的氧化铁质量是4g | D.参加反应的氧化铁中氧元素的质量是2.4g |
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是_____________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请列式计算实验二中16.0样品中各成分的质量。
结论:16.0 g样品中已变质的氢氧化钠的质量是_______g。
在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶质质量分数的稀硫酸,将天平调节至平衡。然后向左盘的烧杯中加入8.4g铁,反应物之间恰好完全反应。欲使天平恢复平衡,则可向右盘的烧杯中加入
| A.8.4g碳酸钠 | B.8.4g氧化钙 | C.8.4g镁 | D.8.4g碳酸镁 |
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1) 恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数为多少?
(2)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示,那么a点对应的溶液中,在单位体积中微粒数目最多的是 (填写化学符号)。
(3)将b点对应的溶液放在蒸发皿中慢慢地蒸干,所得的固体中除了NaCl外,还可能含有__ ____ _(写化学式)
黄铜的主要成分是铜锌合金,将10g黄铜与足量稀硫酸反应,生成0.1g氢气,求该黄铜中铜的质量分数。
(5分)小坊同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质量为20.4 g,为了分离出二氧化锰,她向残渣中加入40℃的水30 g,充分溶解,第一次过滤后得到滤液A和8.4 g残渣,她又向残渣中加入40℃ 的水l0 g,充分溶解,第二次过滤后得到滤液B和5.5 g残渣(假设在实验过程中无损失)。请回答下列问题:
(1)反应的化学方程式为 ___________________________
(2)8.4 g残渣的成分是_______;
(3)利用已知条件列出求原混合物中氯酸钾质量(X)的比例式______ :
(4)将滤液A和滤液B混合,并加入45.1g水,求所得溶液的溶质质量分数______ :
(5)原固体混合物中氯酸钾和二氧化锰的质量比为___________________________。
(已知:40℃ 时,氯化钾的溶解度为40 g)
(7分)某同学做了如下图所示实验:
| |
第一次 |
第二次 |
| 加入镁粉的质量 |
m |
m |
| 加入质量分数为14.6%稀盐酸的质量 |
50g |
lOOg |
| 加入氢氧化钠溶液的质量 |
100g |
100g |
| 加入氢氧化钠溶液后的实验现象 |
产生白色沉淀 |
无明显现象 |
第一次实验每步均恰好完全反应,请回答:
(1)写出第一次实验中发生反应的化学方程式___________________________;
(2)第二次反应后溶液中溶质的组成是___________________________;
(3)每次实验中加入镁的质量(m)为___________________________;
(4)求解第一次反应中生成气体的质量(X)的比例式为___________________________;
(5)若将第一次反应后溶液蒸发掉68.4g水后,则所得不饱和溶液中溶质的质量分数___________;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为_______________。
A、B、C分别是Zn、Cu、Ag三种金属中的一种。为了从它们的混合物中分离
出金属A,并获得B和C的盐,进行如下实验操作:
请回答以下问题: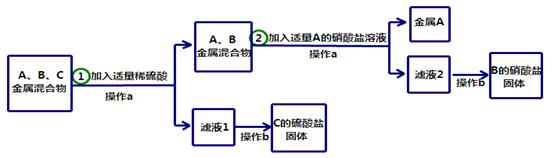
写出步骤①中发生反应的化学方程式 .
A、B、C三种金属的活动性顺序是 > > .
操作b都需要用到玻璃棒的作用是 .
金属A是 (填化学式,下同),B的硝酸盐是 。
把13克的锌投入到98克稀硫酸中恰好完全反应,求生成的氢气的质量是多少?
化学与社会发展。
(1)化学对人类的生活和社会发展做出了巨大的贡献.下列有关主题知识与应用不正确的是( )
A.化学与生活防治骨质疏松--服用钙片
B.化学与能源改善能源结构--开发太阳能、氢能
C.化学与环境减少白色污染--禁止使用塑料制品
D.化学与安全进入久未开启的菜窖--先做灯火试验
(2)“绿色化学”的特点之一是“零排放”。一定条件下,一氧化碳和氢气可以按照不同的比例反应,若只生成一种产物就能实现“零排放”,符合这一要求的产物是( )
A.甲酸(CH2O2) B.甲醇(CH4O )
C.乙醇(C2H6O ) D.乙醛(C2H4O)
(3)甲醇(CH3OH)有毒,误饮可使眼睛失明,甚至死亡。最新研究证明用氨气(NH3)处理含有甲醇的工业废水,能使其转变成无毒的物质。有关反应的化学方程式为:
5 CH3OH+12 O2+6 NH3细菌3N2+5CO2+19H2O,若处理含有0.32%甲醇的工业废水500t。理论上需要氨气多少吨?(计算结果精确到0.01)
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测 定鸡蛋壳中碳酸钙的含量,做如下实验:

反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题:
(1)反应①的化学方程式为;
(2)根据已知条件列出求解碳酸钙质量(
)的比例式;
(3)该鸡蛋壳中碳酸钙的质量分数为;
(4)所加氢氧化钙的质量为;
(5)溶液
中溶质的质量分数为;
(6)用36.5%的浓盐酸配制
上述稀盐酸需加水的质量为。
实验室有一瓶久置的氧化钙,因吸收空气中的水蒸气和二氧化碳而变质,经测定该固体中氢元素的质量分数为0.8%,碳元素的质量分数为2.4%。则已变质的氧化钙占变质前纯氧化钙的质量分数为( )
| A. | 80% | B. | 66.7% | C. | 40% | D. | 18.8% |
向20g锌样品(杂质不溶于水,也不溶于酸)中加入100g质量分数为19.6%的稀硫酸,恰好完全反应。试计算该锌样品中锌的质量分数(写出计算过程)。
试题篮
()