水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。

(1)1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是 (填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
(2)1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为 。该反应若生成1g氢气,则理论上铁制枪管应增重 g。
实验发现枪管实际增重比理论数值大,其可能的原因是 。
(3)1800年,英国化学家尼科尔森通过电解水得到氢气和氧气,后人不断研究和改进该实验。现有某同学在水电解器中加入含酚酞的稀Na2SO4溶液,至充满管A和管B(Na2SO4溶液呈中性且不参与反应)。通直流电一段时间后现象如图2所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是 (填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣,可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有 (填微粒符号)。
(4)当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图3所示。

注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是 、 。
二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加SO2可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤259mg/L。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
2022年我国将有6名航天员生活在空间站。氧气、水、食物等是维持航天员驻留空间站的必要物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用:
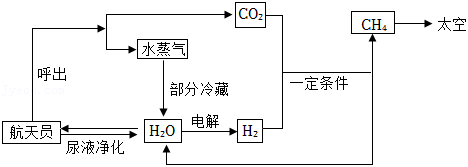
(1)由图可知,目前空间站通过物质循环获得水的途径共有_____条,其中尿液净化时必须除去尿液中的__________等代谢废物。
(2)为实现氧的循环,目前空间站内利用氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,化学方程式为
 。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为:CaCl2+Na2CO3 ═CaCO3↓+2NaCl
四次测量所得数据如表所示:
次数 |
累计加入氯化钙溶液的质量/g |
烧杯中溶液的总质量/g |
一 |
40 |
135 |
二 |
80 |
170 |
三 |
120 |
205 |
四 |
140 |
225 |
(1)恰好完全反应时,生成沉淀的总质量为 g。
(2)第四次测量时,所得溶液中的溶质有 (填化学式)
(3)计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)
取硫酸钠和氯化钠的混合物15g,加入180g水使其完全溶解,再加入100g氯化钡溶液恰好完全反应,过滤,得271.7g滤液(不考虑实验过程中质量的损失)。计算:
(1)该混合物中硫酸钠的质量分数(计算结果精确到0.1%);
(2)反应后所得滤液中溶质的质量分数(计算结果精确到0.1%)。
某课外兴趣小组的同学对二氧化碳的制取和性质进行相关探究。

【实验回顾】
(1)实验室用大理石与稀盐酸制取二氧化碳的化学方程式为 。用向上排空气法收集二氧化碳的原因是 。
【实验探究】
(2)如图1所示,打开汽水瓶盖,有大量气泡冒出,塞上带导管的橡皮塞,导管另一端伸入装有滴加了紫色石蕊溶液的蒸馏水的试管中,轻轻振荡汽水瓶,观察到紫色石蕊溶液变红;加热上述试管,发现溶液颜色由红色变为紫色,写出上述变化过程中反应的化学方程式 , 。
(3)打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随 。
(4)如图2所示,在C处放入用石蕊溶液染成紫色的干燥的纸花完成以下实验:
在A处持续而缓缓地通入气体X.当关闭K时,C处的紫色石蕊纸花不变色;当打开K后,C处的紫色石蕊纸花变为红色。
若气体X为未经干燥的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
若气体X为未经干燥且混有氯化氢的二氧化碳,则B瓶中盛放的溶液可以为 (填字母)。
A.浓硫酸
B.氢氧化钠溶液
C.饱和碳酸氢钠溶液
【交流反思】
(5)该小组用空气样品和提高二氧化碳含量的空气的样品,控制相同条件测定二者在光照前后温度的变化,实验结果如图3.则与空气样品对应的温度变化曲线是 (填"a"或"b"),二氧化碳可以产生温室效应。

请简述温室效应对人类生存环境的功与过: (各写一点)。
化学兴趣小组的同学们在老师的带领下走进实验室,开展实验活动。
(1)实验室依次编号为1、2、3、4的药品柜中,分别存放常见的酸、碱、盐和酸碱指示剂。小刚欲使用熟石灰,他需从 号柜中取出。
(2)小刚发现盛放Na2CO3与NaCl两种溶液的试剂瓶标签脱落,为鉴别两种溶液,分别取样于试管中,加入无色酚酞溶液,若为Na2CO3,则观察到溶液变为 色。
(3)小文从柜中取出标有“10% NaOH溶液”的试剂瓶,取少量样品加入试管中,向其中滴入稀盐酸,发现产生气泡,判断该NaOH溶液中有Na2CO3,用化学方程式表示NaOH溶液变质的原因: 。
小文同学对变质的NaOH溶液进行如下一系列实验,实现药品再利用。
I.测定NaOH溶液中Na2CO3的质量分数
[实验操作]取40.0g 10%的NaOH溶液样品进行如图所示的实验。

[数据处理]
①所取用盐酸(溶质质量分数7.3%)的质量理论上不少于 g。
②如图中,反应前后天平示数相差1.1g,计算NaOH溶液中Na2CO3的质量分数(写出计算过程)。
Ⅱ.变质的NaOH溶液再利用
小文将剩余NaOH溶液倒入烧杯中,加入经计算所需的熟石灰粉末,充分搅拌、静置,过滤,得到NaOH溶液和滤渣。充分搅拌的主要目的是 。
(4)实验结束后,同学们将实验产生的废液和废渣倒入指定的烧杯中,得到无色溶液和白色沉淀,溶液中除一定存在的溶质外,可能存在的溶质是 。
同学们再次实验,确认成分后,对废液回收利用,绿色排放。
2019年春节起,常州大部分地区禁止燃放烟花爆竹,开启了龙城环保新时代。
(1)“禁止燃放烟花爆竹”的安全标志是 。

(2)禁止燃放烟花爆竹不仅可以减少噪声污染、火灾等,还以减少SO2和 等空气污染物的排放,提升空气质量。
(3)爆竹中常含有硫、硝酸钾和木炭的混合粉末,点燃后生成硫化钾(K2S)、氮气和二氧化碳,该反应的化学方程式为 。含硫燃料燃烧产生的SO2会形成 型酸雨,酸雨的pH (填序号)。
A.小于5.6 B.等于7 C.大于7
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一

①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
小王同学想测定某Cu﹣Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为 g。
(2)计算合金中铜的质量分数。

某同学用锌和稀硫酸做了如下实验,并进行相关的定量分析.将一定量的锌放入试管中,向其中加入98g质量分数为10%的稀硫酸,恰好完全反应.
(1)请计算生成氢气的质量(写出计算过程).
(2)通过已知数据还能求出的量有 (填字母,符合题意的选项都选).
a.参加反应锌的质量 b.生成硫酸锌的质量
c.稀硫酸中水的质量 d.反应后溶液中溶质质量分数.
合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程.
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| |
第一次 |
第二次 |
第三次 |
| 加入稀盐酸的体积(ml) |
15 |
15 |
15 |
| 生成氢气的质量(g) |
0.04 |
m |
0.02 |
试求:
(1)m的数值 .
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
某白色固体由BaSO4、BaCO3、Na2CO3、Ba(OH)2中的三种物质组成。为确定其成分,某同学设计并完成如下实验,请把表格中的内容补充完整。(已知:BaSO4不溶于稀盐酸)
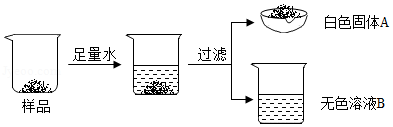
序号 |
Ⅰ |
Ⅱ |
Ⅲ |
操作 |
|
|
|
现象 |
有气泡产生,固体有剩余 |
有气泡产生 |
产生白色沉淀,溶液最终显 色 |
结论或解释 |
原白色固体中含有
|
原白色固体中含有Na2CO3:生成气体的化学方程式为
|
原白色固体中含有BaCO3. |
试题篮
()