学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 |
① |
② |
③ |
④ |
试管内试剂 |
NaOH溶液 |
MgCl2溶液 |
Na2CO3溶液 |
Ba(NO3)2溶液 |
加入稀硫酸后的现象 |
无明显现象 |
无明显现象 |
产生气泡 |
白色沉淀生成 |
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为 。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是 。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl﹣同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42﹣会对Cl﹣的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了如图实验方案。
[设计方案]

沉淀A的化学式是 。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂 改成 。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是 。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是 。
草酸(H2C2O4)存在于自然界的植物中,在170℃以上易分解。某校化学兴趣小组为确定草酸分解产物,做如下探究。
[提出问题]草酸的分解产物是什么?
[猜想与假设]猜想①CO CO2
猜想②CO H2O
猜想③CO2 H2O H2
猜想④CO CO2 H2O
经小组同学分析得出上述猜想 一定是错误的。
[查阅资料]无水硫酸铜是一种白色固体,遇水会变成蓝色。
[进行实验]该小组同学设计了如图的实验过程(部份固定装置已略去)。
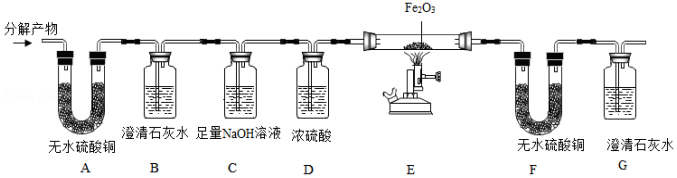
实验步骤 |
实验现象 |
实验结论 |
将分解产物从左至右 依次通过各装置 |
A中无水硫酸铜变蓝 B中澄清石灰水变浑浊 |
猜想②错误 |
F中无水硫酸铜 G中澄清石灰水变浑浊 |
猜想④正确 |
|
问题解答 |
(1)装置C的作用 (2)写出装置E中发生反应的化学方程式 |
|
[交流反思]为防止污染环境,该实验应增加尾气处理装置。
常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
| 加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
| 烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
根据如图实验装置,回答问题:
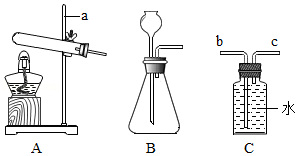
(1)写出图中标有a的仪器名称 ;
(2)写出实验室用B装置制取氧气的化学方程式 ;
(3)若用装置C收集氧气,则氧气应从 (填“b”或“c”)端进入。
不用火,不用电,只需拆开发热包倒入凉水,就能享用美食的自热食品,受到消费者的追捧。

[查阅资料]Ⅰ.发热包中物质的主要成分是生石灰、碳酸钠、铝粉。
Ⅱ.铝和强碱溶液反应生成氢气。
探究一:发热包的发热原理
(1)小明买了一盒自热米饭,取出发热包加入凉水,发生剧烈反应,迅速放出大量的热,写出产生该现象的主要化学反应方程式 ;同时发热包内固体物质变硬、结块。依据观察到的实验现象,小明猜想发热包内的物质可能发生多个化学反应,写出其中一个反应的化学方程式 。
(2)发热包上的安全警示图标有“禁止明火”,其原因可能是 。
(3)小明向使用后的发热包中加入稀盐酸,并对产生的气体展开进一步探究。
探究二:确定气体的成分
[猜想与假设]小明认为该气体可能是:a.H2; b. ; c.CO2和H2的混合气体。
[实验设计]小明同学设计如图实验装置,对气体成分进行探究。
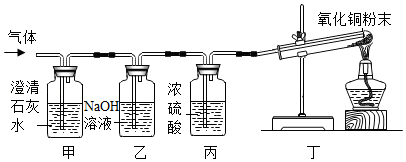
[实验验证]甲装置中的实验现象是 ,丁装置中黑色的粉末逐渐变为红色,试管口有水珠产生,证明猜想c正确。若甲、乙装置交换位置, (填“能”或“不能”)确定气体中含有CO2,写出化学方程式并说明理由 。
[总结与反思]通过以上探究,小明做出如下反思:
A.发热包应密封防潮保存
B.能与水混合放出热量的物质均可做发热包的发热材料
C.使用后的发热包应包好按照垃圾分类投放
你认为其中正确的是 。
实验室按如图步骤配制100g质量分数为22%的蔗糖溶液。
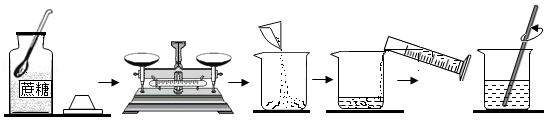 回答下列问题:
回答下列问题:
(1)所需蔗糖的质量为 。
(2)用规格为 (填“50”、“100”或“500”)mL的量筒量取 mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)
(3)溶解时玻璃棒的作用是 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 (填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
请结合如图所示实验回答问题。

(1)A实验中用玻璃棒搅拌的目的是 。
(2)B实验中错误操作造成的后果是 。
(3)C实验正、负极产生的气体体积比约为 。此实验说明水是由 组成的。
下列装置常用于实验室制取气体,请回答问题。

(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰混合制取并收集一瓶较纯净的氧气,应选择的装置是 (填字母序号),反应的化学方程式是 。
(3)实验室可用D装置收集二氧化碳,验满的方法是 。
(4)F装置常用于干燥、收集某气体,该气体具有的性质是 。
SO2是一种大气污染物,也是形成酸雨的主要物质。对含SO2的工业废气进行的无害化处理是打赢蓝天保卫战和保护绿水青山的重要措施。
(1)向含SO2的工业废气中喷洒石灰浆[Ca(OH)2]可有效吸收SO2,生成CaSO3,反应的化学方程式为 。CaSO3可用于制备石膏。
(2)用主要成分为Na2CO3的工业废液吸收工业废气中的SO2可得到Na2SO3,实现了资源的综合利用。反应过程中溶液组成变化如图所示。
①吸收初期(通入废气体积小于V1),发生反应的化学方程式为 。
②不断通入废气,最终产物是 。

某同学进行硫酸铜晶体(化学式为CuSO 4•5H 2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)能判断原硫酸铜溶液已饱和的方法是 。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。

某班同学用氢氧化钠溶液和稀硫酸进行中和反应实验。
(1)甲同学在烧杯中加入约5mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈 色,接着用滴管滴入一定量的稀硫酸,再用玻璃棒搅拌,发现溶液变为无色,该反应的化学方程式为 。
(2)甲、乙、丙同学对反应后溶液中的溶质成分进行探究。
[猜想与假设]反应后溶液中的溶质是什么?
猜想一:只Na 2SO 4
猜想二:
猜想三:Na 2SO 4和NaOH
以上猜想中,可以直接排除的是 ,理由 。
[实验探究]
为了验证另外两种猜想,甲、乙、丙同学设计如下实验方案:
| |
实验操作 |
实验现象 |
实验结论 |
| 甲同学方案 |
取少量反应后的溶液于试管中,向试管中滴加BaCl 2溶液 |
白色沉淀产生 |
猜想二成立 |
| 乙同学方案 |
取少量反应后的溶液于试管中,向试管中加入 |
气泡产生 |
猜想二成立 |
| 丙同学方案 |
取少量反应后的溶液于试管中,向试管中加入生锈的铁钉 |
|
猜想二成立 |
老师认为甲同学方案不合理,你认为理由是 。
[反思交流]实验结束后,废液处理方法正确的是 (填序号)。
A.倒入下水道
B.倒入废液缸
C.带出实验室
举重前运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果,某种“镁粉”中只含有 、 、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、 、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡。请结合实验现象和数据回答问题。
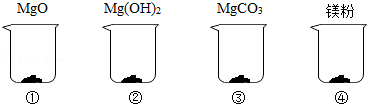
|
物质 |
|
|
|
“镁粉” |
|
消耗稀盐酸的质量/克 |
121.8 |
|
58.0 |
61.9 |
(1)烧杯③中产生的气体是 。
(2)“镁粉”中不只含有 一种物质,理由是 。
(3)表格中 的值为多少?(请写出计算过程)
(4)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和 各4.2克,加入足量稀盐酸,生成相同条件下的气体体积分别为952毫升和1120毫升。由此可知该种“镁粉”的成分是 。
海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请根据粗盐“制碱”的流程图(如图)回答问题:
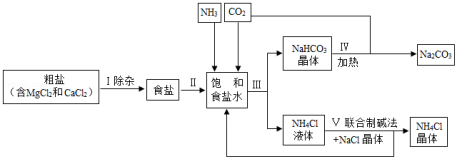
(1)步骤Ⅰ除杂中,常见的方法有两种:一是物理方法,即用NaCl溶液浸洗粗盐,溶解除去其中的可溶性杂质,则浸洗溶液应选用NaCl的 (填“饱和”或“不饱和”)溶液;二是化学方法,操作步骤依次为:加水溶解→加过量试剂①→加过量试剂②→过滤→加适量盐酸,以下试剂①②组合选用合理的是 。
A.①Ca(OH)2②Na2CO3
B.①Na2CO3②Ca(OH)2
C.①KOH②Na2CO3
D.①NaOH②Na2CO3
(2)步骤Ⅲ先向饱和食盐水中通入氨气,再通入二氧化碳,这样做的目的是 ,写出步骤Ⅲ反应的化学方程式 。
(3)步骤Ⅳ发生的反应属于 反应(填基本反应类型)。
(4)我国化学家侯德榜创立的联合制碱法的优点有 。
A.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
B.大大提高了食盐的利用率,节约了成本
C.将“制碱”与制氨生产联合起来,同时析出的NH4Cl晶体可用作复合肥
如图是某化工企业利用“侯氏制碱法”生产纯碱的部分工艺流程示意图:
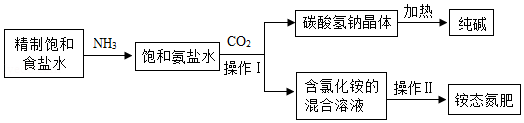
查阅资料知:①NH4Cl NH3↑+HCl↑;②氨气极易溶于水,氨水呈碱性。
(1)检验食盐水是否饱和的方法是 。
(2)操作Ⅰ的名称是 。实验室进行此操作时,玻璃棒的作用是 。
(3)“侯氏制碱法”中,向饱和氨盐水中通入足量的CO2,使氨气、水、NaCl和CO2反应生成NaHCO3等,该反应的化学方程式为 ;先通氨气形成饱和氨盐水,后加压通入二氧化碳,这样操作的目的是 。
(4)处理含氯化铵混合溶液时,不直接加热蒸干得到氯化铵固体的原因是 。
溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.硝酸钾
B.植物油
C.面粉
(2)下列有关溶液的说法中,正确的是 (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
(3)如图为甲、乙、丙三种固体物质的溶解度曲线。
①t 1℃时,甲、乙两种物质的溶解度 (填"相等"或"不相等")。
②t 2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 (填最简比)。
③现有t 1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t 2℃,所得溶液中溶质质量分数大小关系是 (填序号)。
A.甲>乙>丙
B.甲=乙<丙
C.甲=乙>丙
(4)用固体氯化钠和蒸馏水配制50g溶质质量分数为6%的氯化钠溶液,需要氯化钠的质量为 g.若用已配好的50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为 g。

试题篮
()