实验室常用下列装置制取气体,根据所学知识回答下列问题: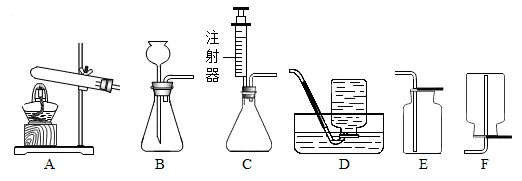
(1)实验室用A、B装置都可以制取氧气,用B装置制取氧气的化学方程式是: ;B装置还可以用来制取 ,该反应的化学方程式是: 。
(2)实验室用过氧化氢溶液和二氧化锰粉末混合来制取氧气,选C做气体发生装置,其优点是 。
(3)汽车尾气中的一氧化氮是一种大气污染物.它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮气体.实验室中制取一氧化氮采用的收集装置是(填序号) .
(4)选择气体的发生装置时,应该考虑的因素有: 反应物的状态和反应条件 .甲烷是最简单的有机物类的气体,实验室常用加热醋酸钠与氢氧化钠固体混合物来制得.实验室制取甲烷应选用的发生装置是(填序号) 。
将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
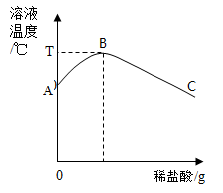
(1)在滴加的过程中,烧杯中溶液的
逐渐(填"增大"、"减小"或"不变")。
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是(填"放热"或"吸热")反应。
(3)图中
点时,溶液中的溶质是(填化学式)。
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
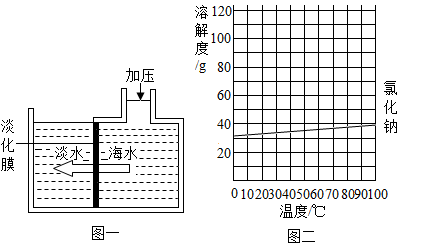
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
碳单质有金刚石、石墨和足球烯(
)等,碳的化合物更是种类繁多。
(1)金刚石由 构成(选填"分子"、"原子"或"离子"),足球烯(
)在氧气中完全燃烧,生成物是.
(2)小苏打片( )可治疗胃酸(主要成分是盐酸)过多,写出反应的化学方程式.
(3)烯烃是一类重要的有机化合物,它由碳、氢两种元素组成,烯烃分子中碳、氢原子数目有一定关系,其关系式可用 表示( ), 表示碳原子个数,当 时是乙烯( ),当 时,其化学式为.
请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度约为1g/mL)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应 (填标号)。
A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡。
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡。
【探究一】在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 (填“有”或“没有”)影响,理由是 .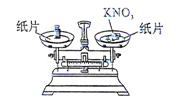
(3)量取:准确量取所需蒸馏水要用到的仪器是 (选填图中的标号)。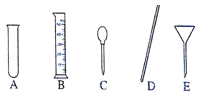
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为: g/mL.
| 温度℃ 质量分数% |
20 |
40 |
60 |
| 4 |
1.023 |
1.016 |
1.007 |
| 10 |
1.063 |
1.054 |
1.044 |
根据下列图示的探究过程,回答下列问题:

(1)操作①的名称.
(2)图中固体中含有的物质(化学式).
(3)写出步骤②发生反应的化学方程式.
20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。

请回答下列问题:
(1)图1中一定是饱和溶液的是溶液(填"甲"或"乙");图2中乙溶液一定是溶液(填"饱和"或"不饱和")。
(2)图3中表示乙的溶解度曲线的是(填"M"或"N");图2中乙溶液降温至30℃析出晶体(填"会"或"不会")。
(3)50℃时甲的饱和溶液中溶质质量分数为(计算结果精确到0.1%)。
酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的,实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:

(1)小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明
必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为;
(2)要检验该氢氧化钠溶液已变质,选择下列试剂不能达到目的是
| A. |
稀 |
B. |
酚酞试液 |
C. |
|
D. |
|
(3)为了验证反应④,小丽将无色酚酞试液分别滴入
溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出。
(4)依据反应②,
能与下列物质反应的是.
| A. |
|
B. |
|
C. |
|
D. |
|
发生反应的化学方程式为:.
(5)硫酸铵[ ]、磷酸二氢钙[ ]、亚硝酸钠( )、硝酸钾( )等属于盐,其中又属于复合肥的。
(1)铝是地壳中含量最多的金属元素,在元素周期表中铝元素的信息如图所示:

①铝的原子结构示意图为;
②铝离子的核外电子数为;
③工业上用电解熔融的方法冶炼铝,化学方程式为:
,该反应属于基本反应类型中的。
(2)要除去下列混合物中的杂质(括号内为杂质),写出除去杂质的化学方程式:
①
;
②
.
人类生产和生活都离不开金属.早在春秋战国时期,我国就开始生产和使用金属.
Ⅰ.随着贵(阳)→广(州)高铁的开通.贵阳已进入高铁时代.高铁建设需要大量的钢铁.那钢铁是怎样炼成的呢?
[原料]赤铁矿(主要成分是氧化铁)、焦炭、空气等.
[流程]主要反应过程如图。

[原理](1)反应的化学方程式:① ,②,③ .
(2)反应①中空气要过量,目的是 .
Ⅱ.锰钢是一种合金,可用于高铁建设.若金属活动性:锰〉铁.请设计实验加以验证.
实验方案是(不用描述实验现象).
Ⅲ.铝合金不但用于日常生活,还用于火箭、飞机的制造.某铝合金只含铝和另一种金属X.为确定其成分,在实验室将mg该铝合金投入稀硫酸中,发现合金完全溶解,并生成ng氢气,铝与稀硫酸反应的化学方程式为.若要确定该合金中金属X的相对原子质量还需要的条件是.
、
、
三种固体物质在水中的溶解度曲线如图所示,请回答:

(1)℃时,
、
两种物质在100
水中达到饱和状态时溶解的质量相等;
(2)若
中混有少量的
,最好采用的方法提纯
;
(3)现有接近饱和的
物质溶液,使其变成饱和溶液的方法有:①加入
物质;②恒温蒸发溶剂;③;
(4)
℃时将20
物质放入50
水中,充分搅拌,所得溶液中溶质的质量分数是;
(5)将
℃时等质量的
、
、
三种物质的饱和溶液降温至
℃时,所得溶液的质量由大到小的顺序是。
2016年5月4日,北京的王女士因混合使用洁厕灵(盐酸)和84消毒液(次氯酸钠)清洁马桶,中毒死亡。其原因是
产生的氯气有毒。
(1)上述反应中,氯元素化合价最高的物质是(填字母)。
| A. | B. | C. | D. |
(2)符号"
"的意义是(答出一条即可)。
(3)《生活饮用水卫生标准》中,允许自来水厂使用氯气对天然水进行灭菌消毒,在此之前还要经过沉降、等净化操作;要求水的总硬度(以碳酸钙计)不超过450mg/L,生活中降低水的硬度的常用方法是。
(4)已知溴元素(
)的原子结构示意图为 ,那么,溴原子核内质子数为,溴原子易电子(填"得到"或"失去")。
,那么,溴原子核内质子数为,溴原子易电子(填"得到"或"失去")。
(5)氯和溴两种元素在周期表中的位置见下图,二者属于同一(填"周期"或"族")。
如图所示,
、
、
为三种物质的溶解度曲线,请根据图示信息回答下列问题。

(1)
℃时,
、
、
三种物质中溶解度最小的是。
(2)
℃时,将20
物质投入100
水中,充分溶解,温度不变,所得溶液为溶液(填"饱和"或"不饱和")。
(3)下列说法正确的是。
| A. |
℃时,将 和 的混合溶液(两者均已达到饱和),降温到 ℃,析出的晶体含有 和 |
B. | 从混有少量 的 物质中提取较纯净的 ,可通过冷却它们的热饱和溶液实现 |
| C. |
℃时,将 、 、 的饱和溶液分别降温到 ℃,所得溶液中溶质质量分数的大小关系是 > > |
D. | ℃时,欲用 的饱和溶液配制10%的 溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器 |
(4)如图所示,向放有镁条的试管中滴加稀盐酸后,锥形瓶中
的饱和溶液变浑浊。请解释原因。

在宏观、微观和符号之间建立联系是化学学科的重要思维方式。(1)根据下列粒子结构示意图,回答问题:

①上述示意图中,共包含种元素,它们之间的本质区别是不同。
②ABCE中属于阴离子的是(填离子符号)
③若D表示某元素的原子,则m=,该粒子在化学变化中容易(选填"得到"或"失去")电子。
④若D为离子,则BD组成的化合物的化学式为 。
(2)下图表示某反应的微观示意图,其中不同的球代表不同元素的原子,请画出X分子的微观示意图。

试题篮
()