请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.18
)配制200
10%稀盐酸。
①配制的主要步骤为:计算、、溶解。
②设需浓盐酸的体积为
,请列出
的计算式(不必算出结果)。
③现提供下图仪器,仪器
的名称为;配制过程中还需要的仪器有。

(2)现提供下列装置:

①实验室制取二氧化碳,发生和收集装置应选用(填序号),发生反应的化学方程式为。实验结束,从反应残留物中提取固体溶质时,按如下流程操作:

②如选用另一发生装置制取某种气体,发生反应的化学方程式为。
过氧化钙晶体﹝
﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:

(1)气体
是
,其名称是;将过氧化钙晶体与溶液分离的方法是。
(2)反应
需控制温度在
,可将反应容器放在中,该反应是化合反应,反应产物是
,请写出化学方程式。获得的过氧化钙晶体中常含有
杂质,原因是。
(3)
的相对分子质量为,过氧化钙晶体﹝
﹞中
、
元素的质量比为。
(4)为测定制得的过氧化钙晶体中
的质量分数,设计的实验如下:称取晶体样品
,加热到
充分反应(方程式为
,杂质不发生变化),测得生成氧气的质量为
,请计算样品中
的质量分数(
相对分子质量为
),写出必要的计算过程。
根据下列坐标图回答:

(1)图一表示甲、乙、丙三种物质的溶解度曲线。
①
时,甲、乙的溶解度均为。
②将甲、乙、丙三种物质
时的饱和溶液升温到
,所得溶液中溶质的质量分数最大的是。
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数。取模拟海水(含
、
)
,向溶液中滴加
的硝酸银溶液,其沉淀质量变化如上图二。
①沉淀的化学式为。
②模拟海水中氯的质量分数是。
实验室常用下列装置来制取、收集气体。请阅读资料卡,回答有关问题。

资料:
1.第八届国际天然气水合物大会于2014年7月29日在北京召开。据中国地质调查局相关负责人透露,我国计划于2015年开始着手开发"可燃冰"(如图)。"可燃冰"主要成分是甲烷水合物,主要分布于深海沉积物或陆域的永久冻土中,1立方米的"可燃冰"可在常温下释放164立方米的甲烷和0.8立方米的淡水,被认为是一种潜力较大的能源之一。

2.通常情况下,甲烷是没有颜色,没有气味的气体,比空气轻,极难溶于水.很容易燃烧。甲烷的实验室制法是:用无水醋酸钠和碱石灰两种固态药品,经研磨均匀混合后装入试管中,加热产生甲烷气体。
(1)仪器
的名称是、。
(2)实验室制取和收集甲烷的装置组合是;将反应物装入试管前,应先检查装置的。简述用排水集气法收集一瓶甲烷气体的操作方法;点燃甲烷前一定要先检验甲烷的。
(3)通过对实验室制取气体的学习,你认为实验室制取气体的反应,共同点是(填序号)。
| A. |
需要加热 |
B. |
需要催化剂 |
C. |
反应物中没有气体参加 |
D. |
反应物中必须含有要制取物质的元素 |
(4)根据物质的组成对甲烷分类,它属于,具有的物理性质是。甲烷除用作燃料外,还是一种很重要的化工原料,在催化剂的作用下,可以将
和
的混合气体直接转化为醋酸(
)。若该反应的原子利用率为100%(反应物中的原子全部转化为目标产物中的原子),则
中的
为,该反应类型是。
(5)可燃冰的开采和利用,能缓解人类面临的能源危机。但开采、利用可燃冰的过程中,还存在着开采技术以及开采过程中可能引发的温室效应、海底滑坡及破坏海洋生态平衡等诸多问题。从科学探究的角度,你认为开采、利用"可燃冰"还应进一步做好。
据报道,全球每年浪费掉的粮食约有1000亿吨,其中,约300亿吨是加工过的食品。下图是一包烤花生的图片,图中的脱氧剂在食品防腐保鲜,特别是对延长含高油脂食品的保质期有着重要作用。请回答下列问题:

(1)花生中富含的营养素是(答出一种即可),检验这包脱氧剂中含有铁粉的方法是。
(2)脱氧剂的作用原理是脱氧剂中的铁粉与氧气、水发生反应生成氢氧化铁,写出该反应的化学方程式,据此判断脱氧剂对食品具有防腐保鲜作用的原因是(填序号)。
a.脱氧剂具有杀菌、消毒的作用
b.脱氧剂吸收水分,使食品保持干燥
c.脱氧剂吸收氧气,防止食品发生缓慢氧化
(3)钢铁是应用最广泛的金属材料,写出工业上炼铁原理的化学方程式;我们日常生活中使用的清洁球,就是用不锈钢丝制作的,这是利用了金属铁具有的;铝、铁、铜三种金属在历史上被人类使用的时间先后顺序是,你认为其原因可能是。
(4)据统计,我国每年因金属腐蚀造成的经济损失约占国民生产总值的2%~4%,防止金属腐蚀具有重要意义。答出一种防止金属腐蚀的措施。
连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一。它的产品除了纯碱外,还有氯化钙和碳酸氢钠。该厂生产纯碱的工艺流程可简单表示如下:

其生产过程中涉及的主要化学反应有:
①
↓
②
↑
请回答:
(1)①"碳化"过程中需要的
,可由石灰石高温煅烧得到,该反应的化学方程式为。
②实验室中,通常用稀盐酸与石灰石反应制取
气体,不选用浓盐酸的理由是;干燥
气体,可用的干燥剂是(填字母)。
| A. |
浓硫酸 |
B. |
固体氢氧化钠 |
C. |
生石灰 |
(2)①该厂"过滤"所得的
可作化肥中的肥,它也可与
在加热时发生反应生成产品
,同时还有
和
生成,写出该反应的化学方程式:。
该厂的另一种产品碳酸氢钠俗称,它的重要用途有(只写一种)。
②实验室进行"过滤"操作时,下列说法正确的有(填字母)
| A. |
使用的漏斗叫长颈漏斗 |
B. |
液面应低于滤纸边缘 |
C. |
玻璃棒应不停搅拌 |
D. |
漏斗下端的管口要紧靠烧杯内壁 |
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:称取样品10.65
,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70
。通过计算(写出计算过程)判断该厂的产品是否属于优等品。(杂质可溶于水且不与氯化钡反应)
方案二:用下图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中
仪器的名称是,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是。(装置的气密性良好)

2015年4月6 日,漳州
项目发生爆炸并引起大火,
项目又一次引起人们的热义。
是1,4-二甲苯(化学式为
)的别称。请计算:
(1)
的相对分子质量为。
(2)
中碳元素的质量分数为(精确到0.1%)。
生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分
)产生硫酸盐,进而生产铜和绿矾,主要流程如下:

(1)分离出矿渣的操作是。
(2)若试剂b为
粉,反应①的化学方程式为。
(3)氢氧化铁与试剂a发生中和反应,反应②的化学方程式为。
亮亮做家务时接触到下列用品。
| 用品 |
脱氧剂 |
洁厕灵 |
炉灶清洁剂 |
| 有效成分 |
还原铁粉 |
盐酸 |
氢氧化钠 |
(1)他清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是。
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理。
(3)他清洗炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是。
(4)做完家务,他用
泡腾片冲了一杯饮料。下列
泡腾片的主要成分中,属于有机物的是(填字母序号)。
A.维生素C( )
)
B.柠檬酸( )
)
C.碳酸氢钠( )
)
在各种金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案:
实验步骤:①连接好装置,②-----③装入药品 ④打开分液漏斗活塞向锥形瓶中滴加入稀盐酸 ⑤一段时间后点燃酒精灯⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞 ⑦数据处理

请回答下列问题:
(1)补全实验步骤②。
(2)若使制取氢气是装置随开随用,随关随停,下列装置可选用的是。

(3)B装置中水的作用,长玻璃管的作用,C装置的作用.
(4)已知: 样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,试用m1,m2列出铜的相对原子质量的表达式。若无F装置,则对测定结果的影响(填"偏大"、"偏小"、"无影响"),以下数据还能测定铜的相对原子质量的是。
| A. | m 2 m 3 | B. | m 3 m 4 | C. | m 1 m 4 | D. | m 2 m 4 |
(5)请你评价实验有什么不妥之处,并说明原因。
硝酸钾溶解度随温度变化的曲线如图所示:

(1)图中
三点中属于不饱和溶液的是。
(2)由
点到
点可采取的措施。
(3)若
溶液中混有少量的
杂质,可以采取方法获得较纯净的
.
(4)若将
点溶液逐渐加水稀释使其质量分数降至10%,在此稀释过程中符合此溶液中溶质质量变化的规律的图像是。

(1)下列氮肥含氮量由高到低的排列顺序是:(用序号表示)
| 常见氮肥 |
①
|
②
|
③
|
| 相对分子质量 |
80 |
79 |
60 |
(2)治理汽车尾气中的
和
的一种方法是:在汽车的排气管上装一个催化转化装置。使
和
反应生成
和
,写出该反应的化学方程式。
(3)有机物中碳氢化合物可用
表示,其完全燃烧的化学方程式:
判断等质量的①
,②
,③
,三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是 (用序号表示)。
为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
分类、类比是学习化学常用的方法。
(1)初中化学有许多实验,若按照实验主要目的可将实验分为:探究化学反应前后物质的质量关系、探究物质的性质、探究物质的含量等。据此应将下列实验中的D与(填"A"或"B"或"C")归为一类,依据是。
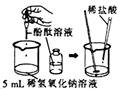 |
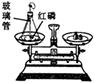 |
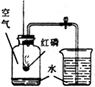 |
 |
| A |
B |
C |
D |
(2)许多物质的命名与元素的化合价高低有关,如锰酸钾、高锰酸钾,其中锰元素的化合价分别为+6、+7。氯元素常见的化合价有+7、+5、+1、-1等,由此推测钠元素、氯元素和+7价氯元素三种元素组成的化合物的名称为,化学式为。
某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部分硫。现欲回收铜和锌,并对硫进行处理,主要流程如下图所示:

(1)在废气
中,一定含有的有害气体是(填化学式)。操作①的操作名称是。
(2)溶液
中含有的溶质是(填化学式)。
(3)写出加入
后发生的化学方程式(写出其中之一即可)。
试题篮
()