请结合下列实验常用装置,回答有关问题。
(1)写出图中标有字母的仪器的名称:a 。
(2)实验室用氯酸钾和二氧化锰制取氧气,应选用的发生装置是 ,反应的化学方程式是 。
(3)实验室制取二氧化碳的反应方程式为 。若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放 (填写试剂名称)。如果用E装置收集该气体,则气体从 端进入(填“b”或“c”)。
(4)实验室常用装置C代替装置B制取气体,该装置的优点是通过开关活塞来控制反应的开始和停止,下列反应适用于该装置的有 (填序号)。
①大理石和稀盐酸 ②过氧化氢溶液与少量二氧化锰粉末 ③锌粒与稀硫酸
金属是一类重要的材料,研究其性质十分必要。
(1)地壳中含量最多的金属元素是 。
(2)人们对铝的利用比铜和铁晚。金属大规模开发和利用的先后顺序主要与 (填序号)有关。
A.金属的活动性 B.金属的导电性 C.金属的导热性
(3)下面是某小组同学对金属镁和铁性质的对比研究。
①在室温条件下进行如右图所示实验。试管内的镁和铁表面均被打磨过,且形状、大小均相同,向两支试管中同时加入相同质量的稀盐酸。
可观察到单位时间内产生气泡多的是 (填“镁”或“铁”),可得出的结论是:金属活动性 > (填元素符号)。
②已知化学反应一般伴随着能量变化,因此,还可以观察到反应在相同时间内,两支长颈漏斗内的液面高度不同,长颈漏斗内液面上升高的是 (填“镁”或“铁”,下同),由此可得出的结论是:在单位时间内,等质量的镁、铁分别与等质量的盐酸反应放出的热量多的是 。
按照题目要求写出化学方程式:
(1)一个能生成二氧化碳的化合反应:
(2)一个能生成二氧化碳的分解反应:
(3)一个能生成二氧化碳的置换反应:
(4)一个能生成二氧化碳的复分解反应: 。
一次性塑料包装袋造成的环境污染已经引起了社会的高度关注,许多城市已经开始使用纸制的食品袋。同学们经过查阅资料,得知食品袋的组成成分含有碳元素和氢元素,请选择以下实验装置进行验证: 
(1)你所选择的实验装置的连接顺序是(用a、b等符号表示)
纯氧→( )→( )→( )→( )→( )
(2)请简单叙述实验现象及结论 。
(3)实验中选择纯氧而不用空气的原因是
。
吴梁在距一支粉笔的粗端2cm处点上一滴蓝墨水,将粉笔插入盛有酒精的培养皿中。过了一段时间,吴梁发现随着酒精的上升,蓝墨水也在粉笔上不断移动,最后蓝墨水在粉笔上分为两个区域,上半部分是蓝色,下半部分是紫色(如右图所示)。根据上述现象回答下列问题:
(1)蓝墨水属于 (填“纯净物”或“混合物”);
(2)由此实验可以作出的推测是 (填序号)。
①用滤纸条代替粉笔重复上述实验,也能得到相似的实验现象
②不同分子在同种介质(如粉笔)中的运动速度不同
③不能用上述实验的原理分离混合物
右图表示的是将盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。请回答:
(1)写出该反应的化学方程式 ,该反应的基本反应类型是 。
(2)从图中可看出该反应的微观本质是 。
已知A物质由两种元素组成,下列反应中能确定“A”物质是由氢、氧两种元素组成的有__________(填序号)。
① A→H2 + O2 ② H2 + O2→A ③ H2 + CuO→Cu + A
④ Fe + A→Fe3O4 + H2 ⑤ NH4HCO3→NH3 + CO2 + A
你作出判断的依据是______________________________(用一句话说明)。
将X溶液滴入Y溶液中,在滴加过程中,Y溶液的pH变化情况如图所示: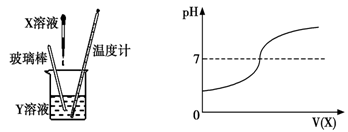
| 溶液 |
A |
B |
C |
D |
| X |
盐酸 |
氢氧化钠 |
盐酸 |
氢氧化钠 |
| Y |
水 |
水 |
氢氧化钠 |
盐酸 |
(1)表格中符合这种变化情况的是 (填写编号),理由是 。
(2)写出该反应的化学方程式为 。
(3)随着X溶液的不断滴入,该烧杯中溶液的温度变化是 。
(4)在Y溶液中滴入石蕊试剂,若不断滴入X溶液,石蕊的变化是 。
(5)当X和Y恰好完全反应时,溶液中的溶质是 ,若要从这溶液中获得大量晶体,应该采用 。
(5分)课堂上老师按图I装置进行分子运动实验时同学们闻到了一股难闻的刺激性气味,课后在老师的指导下,同学们对原实验装置进行了改进,装置如图II所示。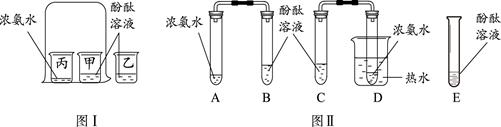
(1)图I大烧杯中的实验现象是 。
(2)同学们按图II装置进行了如下实验操作。
【步骤1】向B、C、E三支试管中分别加入5mL的蒸馏水,各滴入1 ~2滴无色酚酞溶液,振荡,观察溶液颜色。
【步骤2】在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中。
回答问题:
① 实验中, E所起的作用是 。
② 除了证明分子运动,由此实验还可以得到的结论是 ; 。
③ 对比改进前的实验,改进后实验的优点是 。
根据下面四个实验装置图回答问题: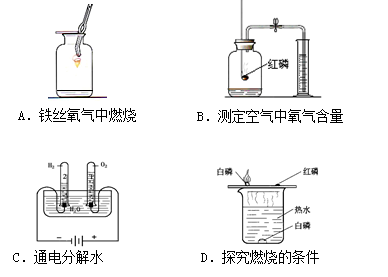
(1)在这些装置图中均有水出现,请说出水在这些实验中的主要作用:
A装置中集气瓶中的水 B装置中量筒中的水
C装置中水槽中的水 D装置中烧杯中的热水
(2)写出 B 装置中所发生反应的化学方程式
完成下列化学方程式
①氢气在氧气中燃烧
②在高温条件下炭粉与氧化铜反应
③用高锰酸钾制氧气
④将铜丝浸入硝酸汞溶液中
上述反应中,属于置换反应的是 ;属于分解反应的是 。(填序号)
Ⅰ某同学用下图所示装置探究可燃物燃烧的条件,得到以下实验事实:
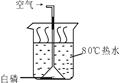
①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧。能证明可燃物必须达到一定温度(着火点)才能燃烧的实验事实是 。
Ⅱ某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:一周后观察:试管①和③中的铁钉无明显变化,试管②中的铁钉明显生锈。探究发现铁生锈的主要条件是铁与 直接接触,其中铁钉中的A、B、C三处中 处锈蚀最严重。试管①中加入的蒸馏水要事先煮沸,其目的是 。以上两个实验均采用的实验方法是 。
溶解度可表示物质溶解性的大小。
①图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
Ⅰ.20℃时,甲的溶解度________(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙________(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃。请填写下表。
| 烧杯中的溶质 |
烧杯中固体的变化 |
| 甲 |
__________________ |
| 乙 |
固体逐渐减少至全部溶解 |
| 丙 |
__________________ |
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越_________。为增大CO2的溶解度,可采用的一种方法是________。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如右图所示,图中t1对应的温度为40℃,则t2对应的温度________(填编号)。
a.大于40℃ b.小于40℃ c.无法确定
学校打算在草坪上造一座假山,用材是花冈岩和太湖石,请你用化学方法区分出这两种石头。经资料查阅得知:花冈岩主要成分为二氧化硅及铝硅酸盐,不能与稀盐酸反应生成气体;太湖石主要成分为石灰岩碳酸盐。
煤在特殊设备内,在高温下能生成煤气。煤气中含有一氧化碳、氢气、甲烷(化学式:CH4)等可燃性气体。
(1)分别写出一氧化碳、氢气、甲烷在空气中完全燃烧的化学方程式。
(2)作为燃料,煤气与煤相比有什么优点。(写出一点)
试题篮
()