根据表中信息判断,下列选项不正确的是
| 序列 |
参加反应的物质 |
生成物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4…… |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- …… |
Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序MnO4- > Cl2 > Fe3+ > Br2
在复杂体系中,确认化学反应先后顺序有利于解决问题.下列反应先后顺序判断正确的是
| A.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn: Ag+、Cu2+、H+、Fe2+ |
| B.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸: AlO2-、Al(OH)3、OH-、CO32- |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2: KOH、Ba(OH)2、BaCO3 |
| D.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
某溶液中含有的溶质是FeBr2、FeI2 ,若先向该溶液中通人一定量的氧气.再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;
②通人氮气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的落液中是否存在;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D①②③④。
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
①I2 + SO2 + 2H2O = H2SO4 + 2HI
②2FeCl2 + Cl2 = 2FeCl3
③2FeCl3 + 2HI = 2FeCl2 + 2HCl+I2
| A.SO2>I->Fe2+>Cl- | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.I->Fe2+>Cl->SO2 |
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关,下列各组物质:
①Cu和HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
将甲、乙两种金属的性质相比较,已知:
①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
| A.①④ | B.①②③ | C.③⑤ | D.①②③④⑤ |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO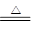 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 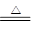 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
根据表中信息判断,下列选项正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4…… |
| ② |
C12、FeBr2 |
FeC13、FeBr3 |
| ③ |
MnO4-…… |
C12、Mn2+…… |
A.第①组反应的其余产物为H2O、MnSO4
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2
在离子浓度相同的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( )
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32— |
| C.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32— |
| D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
根据下列反应判断有关的物质氧化性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3.
| A.H2SO3>I﹣>Fe2+>NO | B.HNO3>Fe3+>I2>H2SO4 |
| C.HNO3>Fe3+>H2SO3>I2 | D.NO->Fe2+>H2SO3>I﹣ |
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+ 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72- > Fe3+ |
| C.CrO42- 和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
试题篮
()