一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应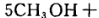
 下列说法正确的是
下列说法正确的是
| A.CH3OH被氧化,表现氧化性 |
| B.此条件下还原性强弱为:N2>CH3OH |
| C.若氧化产物比还原产物多0.2 mol,则该反应中转移3 mole- |
| D.该反应过程中断裂的化学键既有极性键又有非极性键 |
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4 5Cl2+4Fe 2FeCl2+2FeCl3 2FeCl2+2FeCl3 |
| B.n(Cl2)∶n(FeBr2)=1∶1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- |
| C.n(MnO4-)∶n(H2O2)=2∶3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| D.n(Fe)∶n[HNO3(稀)]=1∶3 4Fe+12H++3NO3-===3Fe2++Fe3++3NO↑+6H2O |
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
Fe3+、Br2 |
|
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+5H2O2+6H+=2Mn2++5O2↑+8H2O
在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2+ + 5Z2+8H2O
②2A2+ + 5B2=2A3++2B- ③2B-+ Z2 =B2+2Z-
根据上述反应,判断下列结论错误的是
| A.溶液中可发生:Z2+2A2+=2A3++2Z- | B.Z2在①③反应中为氧化剂 |
| C.氧化强弱顺序为:XO4-> Z2> B2> A3+ | D.X2+是XO4-的还原产物 |
已知氧化性KMnO4>HNO3,Bi位于周期表中第ⅤA族,+3价较稳定,KBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①滴加适量KBiO3溶液,溶液变为紫红色
②继续滴加适量H2O2,紫红色褪去,并有气泡产生
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色
④最后通入足量的SO2气体
请回答下列问题:
(1)KMnO4、KBiO3、H2O2的氧化性由强到弱的顺序是______________________________________。
(2)实验④中的现象为____________________________________________________________。
(3)实验③反应的离子方程式是____________________________________________________。
(提示:该反应须在酸性条件下进行)
已知:2BrO3-+Cl2=Br2 +2ClO3-;5Cl2 +I2 +6H2O =2HIO3 +10HCl;
ClO3-+5Cl-+6H+ =3Cl2+3H2O判断下列物质氧化能力强弱顺序为
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3->Cl2>ClO3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->ClO3->IO3- |
硫氰(SCN)2的化学性质和卤素(X2)类似,称为拟卤素,如(SCN)2+H2O HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是( )
| A.Cl2可以与KSCN溶液反应 |
| B.(SCN)2可以与KI溶液反应 |
| C.KSCN溶液可以与FeCl3溶液反应 |
| D.(SCN)2可以与KBr溶液反应 |
常温下,在溶液中可以发生反应:X+2Y3+═X2++2Y2+,则下列解释:①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+要强.其中正确的是
| A.②④⑥ | B.①③④ | C.②⑤ | D.①③⑤⑥ |
已知下列反应:Co2O3 + 6HCl(浓) = 2CoCl2 + Cl2↑+ 3H2O (I)
5Cl2 + I2 + 6H2O =" 10HCl" + 2HIO3 (II)
下列说法正确的是
| A.反应I中HCl是氧化剂 |
| B.反应II 中Cl2发生氧化反应 |
| C.还原性:CoCl2> HCl > I2 |
| D.氧化性:Co2O3> Cl2>HIO3 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O;
KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。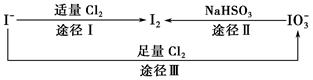
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
臭氧具有强氧化性,可使湿润的碘化钾淀粉试纸变蓝,有关反应如下:
O3 + 2KI + H2O =" 2KOH" + I2 + O2,对于此反应下列说法正确的是
| A.反应中O3是氧化剂,H2O和KI是还原剂 |
| B.在反应中,每消耗1molO3转移2mol电子 |
| C.氧化产物I2和还原产物O2的物质的量之比为1∶1 |
| D.由此反应可知,氧化性强弱顺序为O3>I2>O2 |
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
| A.2W-+Z2=2Z-+W2 | B.2 W-+ Y 2=2 Y-+ W 2 |
| C.2X-+Z2=2Z-+X2 | D.2Z-+X2=2X-+Z2 |
根据表中信息判断,下列选项不正确的是 ( )。
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4…… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-…… |
Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
试题篮
()