下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知常温下,在溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-由此推断下列说法错误的是( )。
| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.Z元素在①反应中被氧化,在③反应中被还原 |
| C.还原性由强到弱的顺序是Z-,B-,A2+,X2+ |
| D.氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+ 下列说法正确的是
| A.H2O2生产过程要严格避免混入Fe2+ |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
| C.在H2O2分解过程中, Fe2+和Fe3+的总量发生变化 |
| D.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
已知反应①2BrO3-+ Cl2=Br2 +2ClO3- ;②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3-+5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3- >Cl2>C1O3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->C1O3->IO3- |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
| A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2 |
| B.通入SO2时,SO2与I2反应,I2作还原剂 |
| C.通入SO2后溶液逐渐变成无色,体现了SO2的还原性 |
| D.滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
向Na2SO3和NaI的物质的量之比为1:1的混合溶液中逐滴滴入氯水,
下列离子反应不可能发生的是
| A.SO32- +Cl2+ H2O → SO42- +2H ++ 2Cl- |
| B.4I-+ SO32- +3Cl2+ H2O → SO42- +2H ++ 6Cl-+2I2 |
| C.2I-+ SO32- +2Cl2+ H2O → SO42- +2H ++ 4Cl-+2I2 |
| D.2I-+ 2SO32- +3Cl2+ 2H2O →2SO42- +4H ++ 6Cl-+I2 |
向溴化铁溶液中加入足量新制氯水,将溶液蒸干并充分灼烧,最后得到的固体是
| A.Fe2O3 | B.FeCl3 | C.FeCl3 和Br2 | D.Fe(OH)3 |
已知下列反应:Co2O3 + 6HCl(浓) = 2CoCl2 + Cl2↑+ 3H2O (I)
5Cl2 + I2 + 6H2O =" 10HCl" + 2HIO3 (II)
下列说法正确的是
| A.反应I中HCl是氧化剂 |
| B.反应II 中Cl2发生氧化反应 |
| C.还原性:CoCl2> HCl > I2 |
| D.氧化性:Co2O3> Cl2>HIO3 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O;
KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。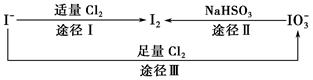
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+―→Cr3++Fe3++H2O ②。下列有关说法正确的是 ( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
臭氧具有强氧化性,可使湿润的碘化钾淀粉试纸变蓝,有关反应如下:
O3 + 2KI + H2O =" 2KOH" + I2 + O2,对于此反应下列说法正确的是
| A.反应中O3是氧化剂,H2O和KI是还原剂 |
| B.在反应中,每消耗1molO3转移2mol电子 |
| C.氧化产物I2和还原产物O2的物质的量之比为1∶1 |
| D.由此反应可知,氧化性强弱顺序为O3>I2>O2 |
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
| A.2W-+Z2=2Z-+W2 | B.2 W-+ Y 2=2 Y-+ W 2 |
| C.2X-+Z2=2Z-+X2 | D.2Z-+X2=2X-+Z2 |
根据表中信息判断,下列选项不正确的是 ( )。
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4…… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-…… |
Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
| A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O |
| B.每生成1 mol I2转移电子2 mol |
| C.O2是还原产物之一 |
| D.该反应能说明O2的氧化性大于I2的 |
试题篮
()