常温下,下列离子浓度的关系正确的是
| A.0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b |
| B.0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C.相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 |
| D.0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
(7分)醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为 。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是 (填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
(3)物质的量浓度均为 0.1 mol/L 的 CH3COONa 溶液和 CH3COOH 溶液等体积混合(混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 。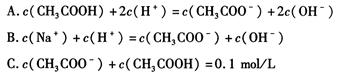
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
| A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
| D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-) |
(18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中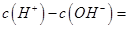 _________ (填字母编号)。
_________ (填字母编号)。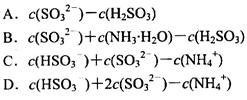
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。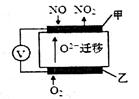
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)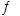 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据: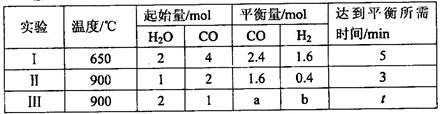
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
常温下,向10mL b mol·L-1的CH3COOH溶液中滴加等体积的0.0l mol·L-1的NaOH溶液,充分反应后溶液中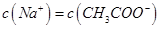 ,下列说法不正确的是
,下列说法不正确的是
| A.b>0.0l |
| B.混合后溶液呈中性 |
C.CH3COOH的电离常数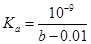 mol·L-1 mol·L-1 |
| D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_______ _,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1 mol/L NaHCO3 ②100ml 0.1 mol/L Na2CO3两种溶液,溶液中水电离出的H+个数:
① ②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:① ②
(3)NaHCO3是一种 (填“强”或“弱”)电解质;写出HCO3―水解的离子方程式: ,常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用NaOH来进行洗气和提纯。
①当150ml 1mol/L的NaOH溶液吸收标准状况下2.24LCO2时,所得溶液中各离子浓度由大到小的顺序为
②几种离子开始沉淀时的PH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时, (填离子符号)先沉淀,
Ksp[Fe(OH)2] Ksp[Mg(OH)2] (填“>”、“=”或“<”),要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。(KspCu(OH)2=2×10-20mol2·L-2)
(12分)(1)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为 mol·L-1 mol·L-1 |
下列比较中,正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则等浓度等体积的NaF溶液比 NaCN 溶液中阴子总数少
B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+)
C.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>④>③
(选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
(1)图中A、B、C、D四点的  由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0. 1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
A.a点表示溶液中c(CH3COO-)约为10 mol/L mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
(18分)
Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为 。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为 ,C的电子式为 。
(2)写出SCl2与氨反应的化学方程式: 。
(3)亚硝酸钠和X固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(4)请设计检验物质X的实验方案: 。
试题篮
()