下列说法正确的是
| A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+) |
B.醋酸与醋酸钠的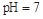 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-) + c(CH3COOH)<c(Na+) |
| C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
下列说法正确的是
A.①表示化学反应2NO2(g) + O3(g)  N2O5(g) + O2(g)△H> 0 N2O5(g) + O2(g)△H> 0 |
| B.②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/LNaOH溶液,溶液的pH随加入酸体积的变化 |
| C.③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/LH2C2O4溶液混合时,n (Mn2+)随时间的变化 |
| D.④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32ˉ)+ c(HCO3ˉ)=" 0.1" mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:
c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
下列图示与对应的叙述相符的是:
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol·L-1氨水滴入20.00 mL1.000 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线
下图为常温下用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH) <V(HA)
D.当0 mL< V(NaOH) < 20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
| A.H2R是二元弱酸,其Ka1=1×10-2 |
| B.当溶液恰好呈中性时,c( Na + )="2c" ( R2- ) + c( HR- ) |
| C.NaHR在溶液中水解倾向大于电离倾向 |
| D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑

(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
【改编】常温下,下列有关叙述正确的是
| A.在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+ c(H2CO3) |
| B.在pH=8的NaB溶液中 :c(Na+)-c(B―)=9.9×10―7 mol•L―1 |
| C.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验 编号 |
c(HA)起始浓度/(mol·L-1) |
c(KOH)起始浓度/(mol·L-1) |
反应后溶液的pH |
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| Ks或Ka |
Ksp=1.8×10-10 |
Ksp=2.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
C.碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 + Cl2+H2O =HCO-3+Cl-+HClO
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO2-4先形成沉淀
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c( )的值保持增大
)的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c( )+c(
)+c( )]
)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c( )、c(
)、c( )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
| A.①④ | B.②④ | C.①③ | D.②⑤ |
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。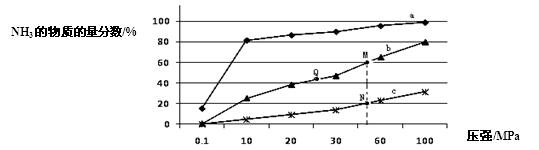
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
试题篮
()