25℃时,下列各项分别由等体积0.1 mol·L-1的两种溶液混合,有关混合后的溶液说法不正确的是( )
| A.Ba(OH)2溶液与Na2SO4溶液:pH="13" |
| B.醋酸与CH3COONa溶液:c(Na+)+c(H+)= c(CH3COO-)+c(OH-) |
| C.Na2CO3溶液与NaHCO3溶液:2c(Na+) = 3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
| D.Na2CO3溶液与NaOH溶液: c(Na+)>c(CO32-)>c(OH-)>c(H+) |
向20mL0.5mol L
L 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH-):b点>a点 |
| C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) |
91:1 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)= c(HSO3-)+2 c(SO32-)
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
| A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与bmol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b |
| C.0.1mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(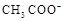 )+c( )+c(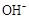 )<c(CH3COOH)+c(H+) )<c(CH3COOH)+c(H+) |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.pH=4的0.1 mol·L-1的NaHC2O4溶液中:c(HC2O4-)>c (H2C2O4)>c(C2O42-) |
| B.0.1 mol·L-1的NaHCO3溶液中:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3) |
| C.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH) |
| D.常温下,等物质的量浓度的三种溶液:①(NH4)2SO4②NH4Cl③(NH4)2Fe(SO4)2中c(NH4+):①<②<③ |
在0.1 mol·L-1的NaHS溶液中,下列关系式正确的是
| A.c(Na+)=c(HS-)+2c(S2-)+c(H2S) |
| B.c(HS-)=c(Na+)+c(H+)-c(OH-)-c(S2-) |
| C.c(OH-)=c(H+)+c(H2S)+c(S2-) |
| D.c(H+)=c(OH-)+c(S2-)-c(H2S) |
归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,C(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0;
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka•Kb=Kw
⑥若反应A(g)="2" B (g) 正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
| A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) |
| D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-) |
下列叙述错误的是 ( )
| A.把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶 液中一定存在:c (K+)+ c (H+) =" c" (CH3COO-) + c (OH-) |
| B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶 液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+) |
| D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴人0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
| A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) |
| B.b点时:c( Na+) ="c(" CH3COO-)>c(H+)="c(" OH-) |
| C.c点时:c(H+)=c(CH3COOH) +c( OH-) |
| D.d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
下列有关物质浓度关系的描述中,正确的是
| A.25℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
| B.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+) |
| C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是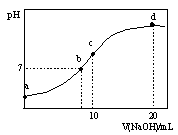
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+) |
25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
| A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-) |
| C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75 |
| D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L |
下列微粒的浓度关系一定正确的是
| A.醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c (Na+)>c(H+)>c(OH一) |
| B.常温下,物质的量浓度相等的①(NH4)2SO4、②(NH4)2Fe (SO4)2、③NH4HSO4、④NH4C1溶液中c(NH4+)的大小顺序为:②>①>③>④ |
| C.pH=3的盐酸与pH=ll的氨水等体积混合液中:c(H+)=c(OH一) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH一)+c(HA一)+c(A2-) |
试题篮
()