下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
短周期元素W、X、Y和Z的原子序数依次增大。W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| B.元素X与W形成的共价化合物有很多种 |
| C.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| D.元素Z可与元素X形成共价化合物XZ2 |
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③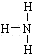 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
下列变化中,不需要破坏化学键的是
| A.加热氯化铵使其分解 | B.氯化钠晶体熔化 |
| C.干冰气化 | D.氯化氢溶于水 |
下列说法正确的是
| A.因为水分子内存在氢键,所以水分子非常稳定 |
| B.氢键属于化学键 |
| C.水分子间存在氢键使水分子间作用力增强,导致水的沸点较高 |
| D.水分子之间无分子间作用力,只有氢键 |
下列说法正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
| B.含有离子键的化合物一定是离子化合物 |
| C.所有金属与所有非金属之间都能形成离子键 |
| D.在化合物Na2O2中,阴、阳离子的个数比为1:1 |
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是
| A.它是一种共价化合物 |
| B.它受热时,可能会分解产生有色气体 |
| C.它不可能与NaOH溶液反应 |
| D.它只含离子键 |
正长石的主要成分为硅酸盐,由前20号元素中的4种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是
| A.X的离子半径>Y的离子半径 |
| B.Z的氢化物的稳定性<W的氢化物的稳定性 |
| C.Y的氧化物既能与盐酸反应,又能与NaOH溶液反应 |
| D.X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
以下各组中的两物质在发生相应变化时所克服的微粒间的作用力完全相同的是
| A.蔗糖溶于水和H2SO4溶于水 |
| B.金刚石熔化和冰熔化 |
| C.干冰升华和液溴挥发 |
| D.食盐粉碎和冰粉碎 |
下列各项中表达正确的是
| A.第VⅡA族元素形成的氢化物中沸点最高的是HI |
| B.水分子很稳定性是因为水分子间易形成氢键 |
C.用电子式表示HCl形成过程: |
| D.第三周期元素形成的简单离子中,半径最小的是Al3+ |
.根据要求的化学用语填写
(1)H2O2的电子式为_______________
(2)C2H2的结构式为__________________
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式__________________________________________________________________
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为__________________________________,负极反应式为____________________________
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。它的电子式是____________________
1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是
| A.N5+共有34个核外电子 |
| B.N5+中氮氮原子间以共用电子对结合 |
| C.化合物N5AsF6中As化合价为+1 |
| D.化合物N5AsF6中F化合价为-1 |
试题篮
()