下列方法能使电离平衡H2O H+ + OH-向左移动的是
H+ + OH-向左移动的是
| A.向水中加入少量氢氧化钠固体 | B.向水中加入少量硫酸铝固体 |
| C.向水中加入少量碳酸钠固体 | D.将水加热到100℃,使水的pH=6 |
下列有关溶液pH的说法正确的是
| A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/L |
| B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11 |
| C.将pH=1的硫酸溶液和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3 |
| D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7 |
向蒸馏水中滴入少量稀盐酸后,下列说法正确的是
| A.c(H+)·c(OH-)比值不变 | B.溶液pH增大 |
| C.c(OH-)降低了 | D.水电离出的c(H+)增加了 |
向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是 ( )
| A.[Co(NH3)4Cl2]Cl | B.[Co(NH3)3Cl3] | C.[Co(NH3)6]Cl3 | D.[Co(NH3)5Cl]Cl2 |
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
| A.溶液呈中性,可选用甲基橙或酚酞作指示剂 |
| B.溶液呈中性,只能选用石蕊作指示剂 |
| C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 |
| D.溶液呈碱性,只能选用酚酞作指示剂 |
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是

pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是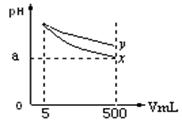
| A.相同温度下,x的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中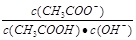 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.完全中和醋酸需加入10mLpH=11的NaOH溶液 |
下列图像表达正确的是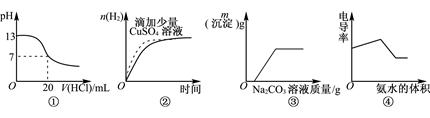
| A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
下列说法正确的是
| A.KW随浓度的改变而改变 |
| B.难溶物质可能为强电解质,如BaSO4是强电解质 |
| C.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
| D.加入反应物,活化分子百分数增大,化学反应速率增大 |
已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则对
| A.高碘酸和碘酸都是强酸 |
| B.高碘酸和碘酸都是弱酸 |
| C.高碘酸是弱酸、碘酸是强酸 |
| D.高碘酸是强酸、碘酸是弱酸 |
室温时,下列混合溶液的pH一定小于7的是
| A.pH=4的盐酸和pH=10的氨水等体积混合 |
| B.pH=2的盐酸和pH=13的氢氧化钡等体积混合 |
| C.pH=5的醋酸和pH=9的氢氧化钡等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
试题篮
()