在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再平衡时,测得A的浓度降低为0.30mol/L,下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再平衡时,测得A的浓度降低为0.30mol/L,下列有关判断正确的是
| A.x+y<z |
| B.平衡向正反应方向移动 |
| C.B的转化率增大 |
| D.C的体积分数降低 |
向某密闭容器中加入0.30mol A、0.10mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.如图2为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各只改变一种条件,所改变的条件均不同.已知t3~t4阶段为使用催化剂.

图1 图2
(1)若t1=20s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)= ; t4~t5阶段改变的条件为 ;(t0为坐标原点)
(2)若t2~t3阶段,C的体积分数在不断地变小,则此阶段v(正) v(逆) (填“>”、“=”、“<”); t3~t4的平衡常数K= 。
(3)t5~t6阶段改变的条件为 ;B的起始物质的量为 ;
(4)t1达到平衡后,若保持容器温度和体积不变,再向容器中加入0.08mol A,0.2mol C,则平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(5)在温度和容积不变条件下,能判断该反应达到平衡的依据是
A.混合气体的平均相对分子质量不变 B.反应体系的总压强不变
C.生成2mol C的同时生成3mol A D.2v生成(A)=3v生成(C)
已知有热化学方程式:SO2(g)+ 1/2 O2(g)  SO3(g) △H =-98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于
SO3(g) △H =-98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于
| A.40% | B.50% | C.80% | D.90% |
下列事实,不能用勒夏特列原理解释的是
| A.实验室常用排饱和食盐水的方法收集氯气 |
| B.工业合成氨控制温度在较高温度(500℃)进行 |
| C.在浓氨水中加入烧碱可用于实验室快速生氨 |
| D.工业上将二氧化硫转化为三氧化硫常通入过量空气 |
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
(1)一段时间后上述反应达到平衡。则下列说法中不正确的是________(填字母)。
A.物质A、B的转化率之比为1∶1
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系
如图所示。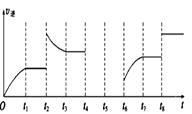
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________; t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
25 ℃,101 k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①(g)+2B(g) 2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
②(s)+B(g) C(g) ΔH2=-310 kJ·mol-1 K2=2
C(g) ΔH2=-310 kJ·mol-1 K2=2
③(g)+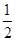 B(g)
B(g) D(l) ΔH3=-200 kJ·mol-1 K3=0.8
D(l) ΔH3=-200 kJ·mol-1 K3=0.8
(1)则反应2E(s)+2F(g)+B(g) A(g)的ΔH= ,K= 。
A(g)的ΔH= ,K= 。
(2)写出反应①的平衡常数表达式: 。
(3)反应②的逆反应的平衡常数K4= 。
(4)对反应①而言,升高温度平衡常数 ,增大压强平衡常数 。(填“增大或降低或不变”)
在密闭容器中,mA(g)+bB(g)⇌pC(g)反应平衡时,测得 c(A)为 0.5mol•L‾1,温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L‾1,则下列判断中正确的是
A.平衡向正反应方向移动 B.物质C的体积分数增加
C.化学计量数:m+b<p D.物质B的转化率减小
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是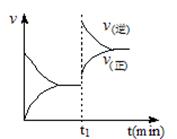
A.2SO2(g)+O2(g) 2SO3(g) △H<0 2SO3(g) △H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0 4NO(g)+6H2O(g) △H<0 |
C.H2(g)+I2(g) 2HI(g) △H>0 2HI(g) △H>0 |
D.C(s)+H2O(g) CO(g)+H2(g) △H>0 CO(g)+H2(g) △H>0 |
实验室测得1mol SO2发生下列化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ/mol。当放出49kJ热量时,SO2转化率最接近于
2SO3(g) ΔH=-196 kJ/mol。当放出49kJ热量时,SO2转化率最接近于
| A.40% | B.50% | C.80% | D.90% |
已知常温下,N2(气)和H2(气)反应生成4mol NH3(气)放出QkJ热量。现有甲、乙两个等体积的密闭容器,在常温下:①向密闭容器甲中通入2molN2和6 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入1 mol N2和3 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
| A.Q1=2Q2=Q | B.Ql>2Q2 | C.Q1<2Q2 | D.Q1=2Q2≠Q |
反应A2+B2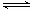 2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是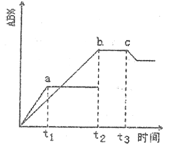
| A.A2、B2及AB均为气体,Q>0 |
| B.AB为气体,A2、B2中有一种为非气体,Q>0 |
| C.AB为气体,A2、B2中有一种为非气体,Q<0 |
| D.AB为固体,A2、B2中有一种为非气体,Q>0 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z (s),以下不能作为反应达到平衡标志的是
Y(g)+Z (s),以下不能作为反应达到平衡标志的是
| A.X的分解速率是Y的消耗速率 的2倍 |
| B.混合气体的压强不再变化 |
| C.混合气体的密度不再变化 |
| D.单位时间内生成lmolY的同时分解2mol X |
反应mA(s)+nB(g)  pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
| A.①②⑤ | B.②④⑤ |
| C.只有①③ | D.①③⑤ |
一定能反映化学平衡向正反应方向移动的是
| A.生成物的物质的量分数增大。 |
| B.v正 > v逆 |
| C.反应物浓度降低 |
| D.反应物的体积分数减少 |
试题篮
()