用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 |
| B.Kw逐渐减小 |
| C.水的电离程度增大 |
D. 变大 变大 |
已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:
2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是
| A.加入适量稀盐酸 | B.加入适量稀硝酸 |
| C.加入适量烧碱固体 | D.加水稀释 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(s)+2B(g) 4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
| A.前2min,D的平均反应速率为0.2mol·L-1·min-1。 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
室温下,水的电离达到平衡:H2O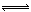 H++OH‾。下列叙述正确的是
H++OH‾。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,KW不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH—)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(0H—)=c(H+) |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |
在一定条件下,固定容积的密闭容器中反应:2NO2(g)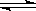 O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是
O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是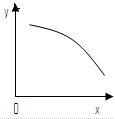
| A.当x表示温度时,y表示NO物质的量 |
| B.当x表示反应时间时,y表示混合气体的密度 |
| C.当x表示压强时,y表示NO2的转化率 |
| D.当x表示NO2物质的量时,y表示O2的物质的量 |
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)="1.0" mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)="1.0" mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
某温度下,在容积固定不变的密闭容器中发生下列可逆反应:X(g) + 2Y(g) 2Z(g)。
2Z(g)。
平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
| A.刚充入时,反应速率V (正)减小,V (逆)增大 |
| B.达到新平衡时,容器内气体的平均相对分子质量增大 |
| C.达到新平衡时,容器内气体的压强是原来的两倍 |
| D.达到新平衡时,容器内气体的百分组成和原来相同 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.向H2S水溶液中加入NaOH有利于S2-增多 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
对可逆反应4NH3(g)+5O2(g) 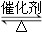 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
下列叙述中可以说明反应2HI(g)  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分组成HI%=I2% ④反应速率v(H2)=v(I2)=1/2v(HI) ⑤[HI]∶[H2]∶[I2]=2∶1∶1 ⑥v(HI)分解=v(HI)生成 ⑦压强不变
| A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
下列反应不是可逆反应的是
| A.CO2+H2O=H2CO3和H2CO3=CO2+H2O |
B.2H2O 2H2↑+O2↑和2H2+O2点燃2H2O 2H2↑+O2↑和2H2+O2点燃2H2O |
C.2SO2+O2 2SO3和2SO3 2SO3和2SO3 2SO2+O2 2SO2+O2 |
| D.H2+I2 △ 2HI和2HI △ H2+I2 |
试题篮
()