某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。 向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐 加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )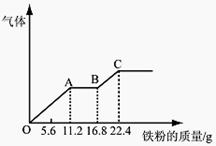
| A.原混合酸中NO3-物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=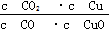 |
B.反应③的平衡常数K=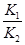 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
关于下列各图的叙述,正确的是
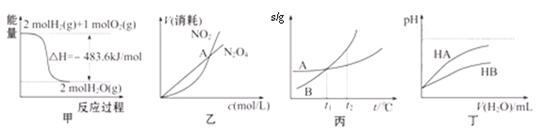
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热(△H)为—241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是
| A.通入乙烯气体 | B.通入SO2气体 | C.加入NaF晶体 | D.加入NaI晶体 |
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O 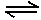 H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入( )
H+ +Cl- + HClO达到平衡后,要HClO浓度增大,可加入( )
| A.Na 2SO3固体 | B.水 | C.CaCO3固体 | D.NaOH固体 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的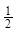 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
反应aM(g)+bN(g) cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
| A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 |
| B.同压同z时,升高温度,平衡时Q的体积分数增加 |
| C.同温同z时,增加压强,平衡时Q的体积分数增加 |
| D.同温同压时,增加z,平衡时Q的体积分数增加 |
某浓度的氨水中存在下列平衡:NH3·H2O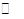 NH
NH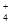 +OH-,如想增大NH
+OH-,如想增大NH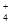 的浓度,而不增大OH-的浓度,应采取的措施是( )
的浓度,而不增大OH-的浓度,应采取的措施是( )
| A.适当升高温度 | B.加入NH4Cl固体 |
| C.通入NH3 | D.加入少量盐酸 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A 升高温度,逆反应速率减小
B.恒温恒容下,增大压强,H2浓度一定减小
C.反应的焓变为正值
D.该反应化学方程式为CO + H2O CO2+ H2
CO2+ H2
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是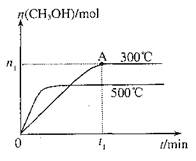
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0–t1 min内CH3OH的平均生成速率为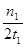 mol•L-1 min-1 mol•L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时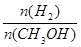 减小 减小 |
下列反应不是可逆反应的是
| A.CO2+H2O=H2CO3和H2CO3=CO2+H2O |
B.2H2O 2H2↑+O2↑和2H2+O2点燃2H2O 2H2↑+O2↑和2H2+O2点燃2H2O |
C.2SO2+O2 2SO3和2SO3 2SO3和2SO3 2SO2+O2 2SO2+O2 |
| D.H2+I2 △ 2HI和2HI △ H2+I2 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.升高温度 | B.加入一种反应物 |
| C.对平衡体系增加压强 | D.使用催化剂 |
试题篮
()