在一定条件下,对于反应mA(g)+nB(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )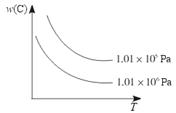
A.ΔH<0,m+n<p+q B.ΔH>0,m+n>p+q
C.ΔH>0,m+n<p+q D.ΔH<0,m+n>p+q
可逆反应A(g)+B C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是( )
C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是( )
| A.增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体 |
| B.若升高温度,C的百分含量减少,则说明正反应为放热反应 |
| C.若增大压强,平衡不移动,则说明B和D一定都是气体 |
| D.如果B是气体,则增大A的浓度会使B的转化率增大,A的转化率减少 |
室温下,水的电离达到平衡:H2O H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
| A.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大. |
| B.将水加热,平衡向正反应方向移动,Kw不变 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+) |
在一密闭容器中充入1molNO2气体,建立如下平衡2NO2  N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
| A.a>b | B.b>a | C.a=b | D.无法比较 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g) 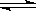 MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
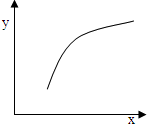
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
在刚性密闭容器中加入P、Q发生下列反应,P(g)+2Q(g)  2S(g)+R(s)下列说法可以说明反应已达平衡的是
2S(g)+R(s)下列说法可以说明反应已达平衡的是
| A.反应容器中压强不随时间变化而变化 |
| B.反应容器中P、Q、R、S四者共存 |
| C.P和R的生成速率相等 |
| D.反应容器中物质的总物质的量保持不变 |
在一定温度下,下列叙述说明可逆反应A(g)+2B(g)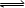
 2C(g) 达到平衡的( )
2C(g) 达到平衡的( )
A.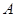 、 、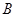 、 、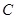 的浓度之比为1:2:2 的浓度之比为1:2:2 |
B.单位时间内消耗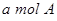 ,同时生成2a mol C ,同时生成2a mol C |
C.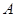 的浓度不再变化 的浓度不再变化 |
| D.混合气体总物质的量为2a mol |
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |
下列事实可以用勒夏特列原理解释的是( )
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产率 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq) I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。
I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。
下列说法不正确的是
| A.状态a与状态b相比,状态b时I2的转化率更高 |
B.反应I2(aq)+I-(aq) I3-(aq)△H<0 I3-(aq)△H<0 |
| C.若T1时,反应进行到状态d时,一定有υ正>υ逆 |
| D.温度为T1时,向该平衡体系中加入KI固体,平衡正向移动 |
下图是可逆反应X2+3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是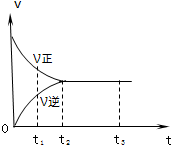
| A.t1时,只有正方向反应 | B.t1~t2时,X2的物质的量越来越多 |
| C.t2~t3,反应不再发生 | D.t2~t3,各物质的浓度不再发生变化 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是
| A.通入乙烯气体 | B.通入SO2气体 | C.加入NaF晶体 | D.加入NaI晶体 |
已知:在一定温度下,H2(g) + I2(g)  2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)
2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)  HI(g)的平衡常数为K2,则K1、K2的关系为
HI(g)的平衡常数为K2,则K1、K2的关系为
| A.K1=K2 | B.K1=2K2 | C.K1=1/2K2 | D.K1=K22 |
试题篮
()