对于可逆反应:m A(g) + n B(g) x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是 
| A.△H > 0, m + n > x | B.△H > 0, m + n < x |
| C.△H < 0, m + n < x | D.△H < 0, m + n > x |
可逆反应N2(g)+3H2(g) 2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol N2的同时,生成3n mol H2
②断开1mol H-H键的同时断开2 molN-H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变
| A.②④ | B.①④ | C.①③④ | D.②③④⑤ |
在某密闭容器中充入HI气体发生反应:2HI(g) H2(g)+I2(g) △H<0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g) △H<0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 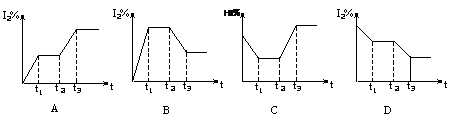
对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
现向一密闭容器中充入1 mol N2和 3 mol H2,在一定条件下开始反应。下列有关说法中正确的是( )
| A.达到化学平衡时,将生成2 mol NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
可逆反应N2+3H2 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
| A.2v正(H2)=3v 逆(NH3) | B.3v正(N2)=v 正(H2) |
| C.v正(N2)=v 逆(NH3) | D.v正(N2)=3v 逆(H2) |
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是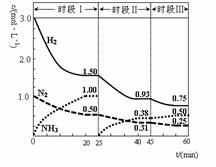
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应 NO2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
A. |
B. |
C. |
D. |
已知:N2(g)+3H2(g) 2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是: ( )
2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是: ( )
A.Q1= Q Q |
| B.达到平衡时,甲容器中H2的转化率为25% |
C.平衡时甲容器中气体的压强为开始时压强的 |
| D.平衡时甲容器中NH3(g)的体积分数比乙容器中的小 |
密闭容器发生下列反应aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A 升高温度,逆反应速率减小
B.恒温恒容下,增大压强,H2浓度一定减小
C.反应的焓变为正值
D.该反应化学方程式为CO + H2O CO2+ H2
CO2+ H2
关于下列各图的叙述,正确的是
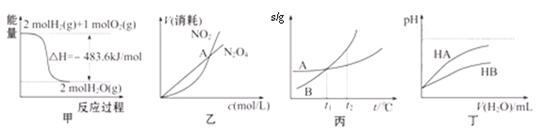
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热(△H)为—241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
某温度下,反应SO2(g)+ 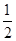 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) + 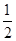 O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
| A.2500 | B.100 | C.0.02 | D.0.001 |
汽车尾气净化中的一个反应如下:
 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
试题篮
()