下列事实中,不能用勒夏特列原理解释的是 ( )
A .对熟石灰的悬浊液加热,悬浊液中
.对熟石灰的悬浊液加热,悬浊液中 固体质量增加
固体质量增加
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
把3 mol A和2 mol B混合于2 L密闭容器中,发生反应:3A(g)+B(g)  xC(g)+2D(g),反应5 min后,测得容器内压强变小,D的平均反应速率为0.1 mol/(L·min),下列结论错误的是
xC(g)+2D(g),反应5 min后,测得容器内压强变小,D的平均反应速率为0.1 mol/(L·min),下列结论错误的是
| A.A的平均反应速率为0.15 mol/(L·min) |
| B.5 min时,C的浓度为0.25 mol/L |
| C.5 min时,B的转化率为20% |
| D.5 min时,容器内压强为原来的0.9倍 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g) , 反应过程中测定的部分数据见下表(表中t1>t2): 下列说法正确的是
CO2(g)+H2(g) , 反应过程中测定的部分数据见下表(表中t1>t2): 下列说法正确的是
| 反应时间/min |
n(CO)/mol |
H2O/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
反应 2NO2(g) N2O4(g) △H<0,在温度分别为T1、T2 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2O4(g) △H<0,在温度分别为T1、T2 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
| A.a、c两点的反应速率:a>c |
| B.a、c两点NO2的转化率:a>c |
| C.b、c两点的化学平衡常数:b=c |
| D.由状态b到状态a,可以用加热的方法 |
已知一定条件下:A2B5(g)  A2B3(g)+B2(g) A2B3(g)
A2B3(g)+B2(g) A2B3(g)  A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
| A.0.1mol/L | B.0.2mol/L | C.0.9mol/L | D.1.5 mol/L |
可逆反应①X(g)+2Y(g)
 2Z(g) 、②2M(g)
2Z(g) 、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,下列判断正确的是
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,下列判断正确的是
| A.反应①的正反应是吸热反应 |
| B.达平衡(I)时,X的转化率为5/11 |
| C.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 |
| D.在平衡(I)和平衡(II)中M的体积分数相等 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:下列说法正确的是
(已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) kJ·mol
kJ·mol )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的平衡浓度(mol·L ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
 |
 |
 |
A. B.a+b>92.4 C.
B.a+b>92.4 C. D.
D.
合成氨的热化学方程式为


 。现将1mol
。现将1mol 3mol
3mol 充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为
充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为 ,下列说法中正确的是( )
,下列说法中正确的是( )
| A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为 ,则容器I放出热量与容器II吸收热量之和为92.4kJ ,则容器I放出热量与容器II吸收热量之和为92.4kJ |
| D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
现有下列四个图像:
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) 2NH3(g) ΔH1<0 2NH3(g) ΔH1<0 |
B.2SO3(g)  2SO2(g)+O2(g)ΔH2>0 2SO2(g)+O2(g)ΔH2>0 |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH3<0 4NO(g)+6H2O(g) ΔH3<0 |
D.H2(g)+ CO(g) C(s)+H2O(g) ΔH4>0 C(s)+H2O(g) ΔH4>0 |
一定温度下反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
| A.单位时间里每增加1molN2,同时减少2molNH3 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.N2与H2的物质的量与NH3的物质的量相等 |
| D.N2、H2和NH3的质量分数不再改变 |
在一定容积的密闭容器中发生反应:X(g)+Y(g)⇌Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。下列有关判断正确的是
X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。下列有关判断正确的是
| A.甲图表示温度对X转化率的影响,且Ⅰ温度较低 |
| B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高 |
| C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高 |
| D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ,Ⅲ<Ⅳ |
反应aA(g)+bB(g)  cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: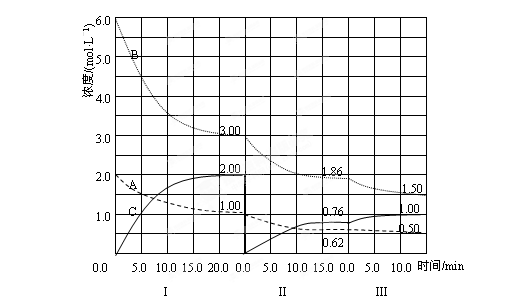
回答问题:
(1) 反应的化学方程式中,a:b:c为_____________;
(2) A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________;
(3) 由第一次平衡到第二次平衡,平衡移动 的方向是_________,采取的措施是________;
的方向是_________,采取的措施是________;
(4) 比较第Ⅱ阶段反应温度(T2) 和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________;
和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________;
(5) 达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度 随时间变化的趋势(曲线上必须标出A、B、C)。
随时间变化的趋势(曲线上必须标出A、B、C)。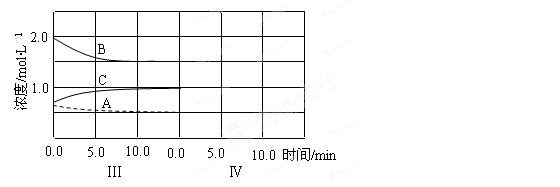
在恒温时,一固定容积的容器内充入1 mol NO2(g),发生如下反应:2NO2(g) N2O4(g),达平衡时,再向容器内通入1mol NO2(g),重新达到平衡后,与第一次平衡时相比,容器内的压强
N2O4(g),达平衡时,再向容器内通入1mol NO2(g),重新达到平衡后,与第一次平衡时相比,容器内的压强
| A.不变 | B.增大不到原来2倍 | C.增大到原来2倍 | D.无法判断 |
试题篮
()