A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表: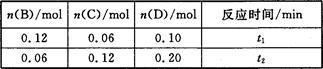
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=O.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.化学反应速率的关系是2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.达到化学平衡时4v正(O2)=5v逆(NO) |
在2A﹢B 2C﹢D反应中,表示该反应速率最快的是( )
2C﹢D反应中,表示该反应速率最快的是( )
A.v(A)=0.8mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C) =0.6mol·L-1·s-1 D.v(D)=0.5mol·L-1·s-1
据报道,美国已经找到名为Trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨。该催化剂的作用是
| A.降低生产能耗 | B.使反应物的化学键不需破坏 |
| C.使反应更完全 | D.使反应放出更多的热量 |
对于可逆反应A(g)+3B(g)⇌2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.V(A)="0.5" mol/(L・min)
B.V(B)="1.2" mol/(L・min)
C.V(C)="0.4" mol/(L・min)
D.V(C)="1.1" mol/(L・min)
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( ) 
| A.该反应的化学方程式为: 3Z = 3X+2Y |
| B.t0时,X、Y、Z的质量不再改变 |
| C.t0时,Z的浓度为1.2 mol/L |
| D.t0时,反应停止,反应速率为0 |
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |
在合成氨反应中:N2+3H2 2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
| A.0.44S | B.1S | C.1.33S | D.2S |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为

| A.V(NH3)=0.010mol/(L·S) | B.V(O2)=0.0010mol/(L·S) |
| C.V(NO)=0.0010mol/(L·S) | D.V(H2O)=0.045mol/(L·S) |
对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时4v正(O2)=5v逆(NO)。 |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态。 |
| C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大。 |
| D.化学反应速率关系:2v正(NH3)=3v正(H2O)。 |
合成氨的反应为:3H2 + N2 2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
| A.v(H2)=v(N2)= v(NH3) | B.v(H2)=3 v(N2) |
| C.v(N2)=2 v(NH3) | D.v(NH3)=3/2v(H2) |
下列各选项中所述的两个量,前者一定大于后者的是
| A.室温下,1L0.3mol·L-1CH3COOH溶液和3L0.1 mol·L-1CH3COOH溶液中的H+数 |
| B.纯水在25℃和80℃时的pH |
| C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| D.相同条件下,H2分别与Cl2、F2反应的反应速率 |
440℃时反应:2E(g) + F(g) 2G(g) △H。在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入E(g)和F(g),经5min达到平衡。其起始物质的量及E的平衡转化率如下表所示。
2G(g) △H。在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入E(g)和F(g),经5min达到平衡。其起始物质的量及E的平衡转化率如下表所示。
| |
甲 |
乙 |
丙 |
|
| 起始物质的量 |
n(E)/mol |
0.4 |
0.8 |
0.8 |
| n(F)/mol |
0.24 |
0.24 |
0.48 |
|
| E的平衡转化率 |
80% |
α1 |
α2 |
|
下列判断中,错误的是
A.5min内甲中E的平均反应速率为0.032mol·L-1·min-1
B.甲容器中若混合气体的平均相对分子质量不变则该反应达到平衡状态
C.平衡时,E的转化率:α1<80%<α2
D.若温度为500℃时,测得该反应的平衡常数K=100,则△H>0
试题篮
()