将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H2 2NH3,下列关于该反应的说法中正确的是
2NH3,下列关于该反应的说法中正确的是
| A.增大压强,反应速率减小 |
| B.最终可生成0.2 mol NH3 |
| C.升髙温度,反应速率增大 |
| D.当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
T℃时,A、B 两种气体反应生成 C 气体。反应过程中 A、B、C 浓度变化如图(I)所示 , 若保持其他条件不变,温度分别为 T1和 T2时,B 的体积分数与时间的关系如图(II)所示 ,则下列结论正确的是 ( )
A.该反应的热化学方程式 A(g)+2B(g)=2C(g)△H= -285.84KJ•mol-1
B.该反应中 T1<T2
C.其他条件不变,升高温度,正、逆反应速率均增大,且 A 的转化率增大
D.T℃时,在相同容器中,若由 0.3 mol/L A、0.1 mol/L B 和 0.4 mol/L C 反 应,达到平衡后,C 的浓度仍为 0.4 mol/L
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是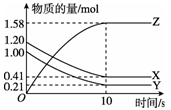
| A.反应开始到10 s时,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s时,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应开始到10 s时,Y的转化率为39.5% |
D.反应的化学方程式为X(g)+Y(g) 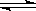 2Z(g) 2Z(g) |
在不同条件下,分别测得反应2SO2+O2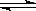 2SO3的速率如下,其中最快的是
2SO3的速率如下,其中最快的是
| A.v(SO2)=4 mol/(L·min) | B.v(O2)=2 mol/(L·min) |
| C.v(SO2)=0.1 mol/(L·min) | D.v(SO2)=0.1 mol/(L·s) |
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.V(A) = 0.7mol·L-1·min-1
B.V(B) = 0.3mol·L-1·min-1
C.V(C) = 0.9mol·L-1·min-1
D.V(D) = 1.1mol·L-1·min-1
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A.v(CO)=1.5 mol·L-1·min-1 | B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 | D.v(CO2)=1.1 mol·L-1·min-1 |
对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
反应4A(g)+5B(g)="=" 4C(g)+ 6D(g)在某密闭容器中进行,半分钟后,C的物质的量浓度增加了0.3mol/L。下列论述正确的是( )
A.半分钟内的平均反应速率:5v(B)=6v(D) B.C的平均反应速率是0.010 mol·L-1·s-1
C.容器中含D的物质的量至少为0.45mol D.容器中A的物质的量浓度增加了0.3mol/L
常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )
| A.E2 | B.E2-E1 | C.E3-E2 | D.E3 |
在合成氨反应中:N2+3H2 2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L·S),则这段时间为
| A.0.44S | B.1S | C.1.33S | D.2S |
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )

| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为

| A.V(NH3)=0.010mol/(L·S) | B.V(O2)=0.0010mol/(L·S) |
| C.V(NO)=0.0010mol/(L·S) | D.V(H2O)=0.045mol/(L·S) |
对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时4v正(O2)=5v逆(NO)。 |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态。 |
| C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大。 |
| D.化学反应速率关系:2v正(NH3)=3v正(H2O)。 |
试题篮
()