实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2SO4粉末 | D.K2SO4固体 |
对于反应COCl2(g) CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
| A.①②⑤ | B.①③⑤ | C.②④⑥ | D.③⑤⑥ |
把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
| A.20 mL 3 mol·L-1 | B.20 mL 2 mol·L-1 |
| C.10 mL 4 mol·L-1 | D.10 mL 2 mol·L-1 |
下列说法正确的是
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 |
| B.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| D.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
|
无 |
| ③ |
10 mL 5% H2O2溶液 |
MnO2固体 |
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
一定温度下,反应N2(g)+O2(g) 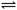 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He |
| C.恒容,充入O2 | D.恒压,充入N2 |
关于反应速率的说法中,正确的是
| A.反应速率用于衡量化学反应进行的快慢 |
| B.决定反应速率的本质因素是反应温度 |
| C.可逆反应达到化学平衡时,正逆反应速率都为0 |
| D.增加反应物物质的量,能增大反应速率 |
下列说法合理的是
A.增加反应物的用量,化学反应速率一定加快
B.在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
C.难溶物A、B,KSP(A)>KSP(B),则溶解度S(A)>S(B)
D.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为碳酸钠
下列关于催化剂的说法,正确的是
| A.催化剂能使不起反应的物质发生反应 |
| B.在化学反应前后催化剂性质和质量都不改变 |
| C.催化剂能加快化学反应速率 |
| D.在化学反应过程中,催化剂能提高转化率 |
下列四支试管中,双氧水分解的化学反应速率最大的是
| 试管 |
温度 |
过氧化氢浓度 |
催化剂 |
| A |
室温(25℃) |
12% |
MnO2 |
| B |
室温(25℃) |
4% |
无 |
| C |
水浴加热(50℃) |
12% |
无 |
| D |
水浴加热(50℃) |
12% |
MnO2 |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
下列说法正确的是
| A.参加反应物质的性质是决定化学反应速率的主要因素 |
| B.化学反应速率只能加快不能减慢 |
| C.决定化学反应速率的主要因素是浓度 |
| D.增加反应物的用量一定能增大反应速率 |
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
对于反应2H2O2=2H2O +O2↑,下列措施能加快化学反应速率的是
| A.减小H2O2溶液的浓度 |
| B.降低H2O2溶液的温度 |
| C.向H2O2溶液中加入少量MnO2粉末 |
| D.向H2O2溶液中加入NaCl溶液 |
试题篮
()