在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
Ca(OH)2(s) 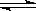 Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
| A.c(Ca2+)增大 | B.c(Ca2+)不变 |
| C.c(OH-)增大 | D.Ca(OH)2固体的质量不变 |
下列说法不正确的是
| A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
| B.常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 |
| C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的ΔH﹤0 |
| D.0.1mol·L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
下列说法正确的是
| A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变小 |
| B.25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成 |
| C.25℃时,向CaCl2溶液中通入SO2,有白色沉淀生成 |
| D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
下列叙述正确的是
| A.KSp[MgF2]>KSp[Mg(OH)2],不能实现Mg(OH)2转化为MgF2。 |
| B.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 |
现将足量的AgCl(s)分别放入下列物质中,所得溶液中c(Ag+) 浓度最小是
| A.10 mL 0.1mol·L-1MgCl2溶液 |
| B.20 mL 0.5 mol·L-1 AgNO3溶液 |
| C.40 mL 0.1mol·L-1HCl溶液 |
| D.5 mL蒸馏水 |
将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)最小的是
| A.10 mL 0.4 mol.L-1的盐酸 | B.10 mL 0.3 mol.L-1MgCl2溶液 |
| C.10 mL 0.5 mol.L-1NaCl溶液 | D.10 mL 0.1 mol.L-1A1C13溶液 |
已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 |
Zn(OH)2 |
ZnS |
AgCl |
Ag2S |
MgCO3 |
Mg(OH)2 |
| 溶度积 |
5×10-17 |
2.5×10-22 |
1.8×10-10 |
6.3×10-50 |
6.8×10-6 |
1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是
A.2AgCl+Na2S===2NaCl+Ag2S
B.MgCO3+H2O Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
C.ZnS+2H2O===Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O
一定温度下,氯化银在水中存在溶解平衡 AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.③>①>②>④ | B.②>①>④>③ |
| C.④>③>②>① | D.①>③>④>② |
一定温度下,氯化银在水中存在溶解平衡 AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.③>①>②>④ | B.②>①>④>③ |
| C.④>③>②>① | D.①>③>④>② |
已知20ºC时AgBr的溶解度为8.4×10—6AgCI的溶解度为1.5×10—4将AgCI与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银,发生的反应为
| A.只有AgBr沉淀生成 | B.AgCl沉淀多于AgBr沉淀 |
| C.AgCl沉淀少于AgBr沉淀 | D.AgCl和AgBr沉淀等量生成 |
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25℃) |
8.0×10﹣16 |
2.2×10﹣20 |
4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
下列实验操作对应的实验现象和解释或结论都正确的是
| 选项 |
实验操作 |
实验现象 |
解释或结论 |
| A |
把S02通人紫色石蕊试液中 |
紫色褪去 |
S02具有漂白性 |
| B |
向NaOH溶液中滴加足量的MgCl2溶液, 然后再滴加足量的CuCl2溶液 |
先产生白色沉淀,然 后沉淀变蓝色 |
 |
| C |
向某溶液中滴加KSCN溶液 |
溶液变红色 |
溶液中含有Fe2+ |
| D |
将充满N02的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2⇋N2O4的△H<0 |
已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中物质的量浓度为( )
| A.1.4×10-6 mol·L-1 | B.2.3×10-6 mol·L-1 |
| C.1.4×10-9 mol·L-1 | D.2.3×10-9 mol·L-1 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
| A.通过加水稀释可以使溶液由b点变到a点 |
| B.加入适量BaCl2(固体) 可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp等于c点对应的Ksp |
试题篮
()