已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
Ba2+对人体有毒,医学上进行消化系统X射线透视时,常用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是:
__________________________________________________________。
万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为__________mol/L。
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发 现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: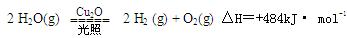 2 H2O(g)
2 H2O(g)
2 H2(g) + O2(g)△H=+484kJ· mol-1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:
Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+被氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.KOH C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4不一定能达到除去Fe3+而不损失Cu2+的目的。乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________。(填“可行”或“不可行”)。
(10分)如表是不同温度下水的离子积数据:试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
(1)若25<t1<t2,则KW___1×10-14(填“>”、“<”或“=”),作出此判断的理由是__。
(2)25℃下,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1:V2=_______。此溶液中各种离子的浓度由大到小的排列顺序是___________。
A、B、C、D分别为(NH4)2SO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,现进行如下实验:
①实验测得A溶液和D溶液显碱性,B溶液和C溶液显酸性;
②A溶液和D溶液混合可生成沉淀甲
③足量A溶液与B溶液混合共热可生成沉淀乙和刺激性气味气体;
请回答:
(1)B的化学式为________;沉淀甲的化学式为________。
(2)足量A溶液与B溶液混合共热生成沉淀乙和刺激性气味气体的离子方程式为 。
(3)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(4)D溶液中各离子浓度由大到小的顺序为 。
(5)已知25℃时沉淀甲的Ksp=5.1×10-9 mol2·L-2,沉淀乙的Ksp=1.1×10-10 mol2·L-2。将沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙。写出该转化反应的离子方程式: 。
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(以被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为: _______________
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)由上述Ksp判断,在上述(2)的体系中,能否实现AgY向AgZ的转化,并简述理由: _______
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s)  Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)  Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是___________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为____________________________。
(12分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: 。
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断: (选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为____________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为__________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
(1)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
②若加入更多的AgI固体,则c(Ag+)________
③若加入固体AgCl,c(I-)________,而c(Ag+)________
(2)右图分别是量筒、滴定管的一部分,则:滴定管应该是_______(填编号),读数为_______mL(虚线标注处);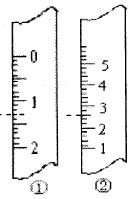
(3)室温下,甲溶液的pH是4,乙溶液的pH是5;甲溶液与乙溶液的c(H+)之比为_________;
(共4分)已知在Ca3(PO4)2的饱和溶液中存在平衡:
Ca3(PO4)2(s)  3Ca2+(aq)+2PO43-(aq)
3Ca2+(aq)+2PO43-(aq)
(1)溶度积Ksp=______________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,
c(PO43-)=1.58×10-6 mol·L-1,则Ksp=_______ _________。
(6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c(HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
试题篮
()