(8分)某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g,试通过计算回答:
(1)该混合气体由哪两种烃组成?
(2)该混合气体中两种烃的体积分数分别是多少?
(本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2
2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2gCu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中,发生反应:3X(g) + Y(g) ="==" nZ(g) +2W(g) , 5min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol.L-1.min-1.计算:
(1)n的值为
(2)前5 min内用X表示的反应速率
(3)5 min末Y的浓度
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物经过浓硫酸后,质量增加10.8g;再通过灼热的CuO,充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)试推断该有机物的分子式。
(2)0.2mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式。
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应: A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
【原创】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题: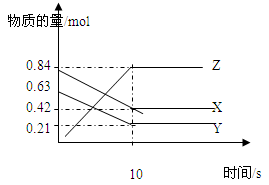
(1)反应的化学方程式。
(2)反应开始到10s,用X表示的反应速率为多少?
(3)Y的平衡转化率。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应:A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
【原创】在一定温度的密闭容器中将氨气充入容器中,进行如下的反应:2NH3 N2+3H2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NH3)=0.6 mol/L,c(N2)=0.2 mol/L。试求:
N2+3H2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NH3)=0.6 mol/L,c(N2)=0.2 mol/L。试求:
(1)氨气的转化率为多少?
(2)反应前后的压强比为多少?
(3)计算该温度下氮气的体积分数.
(4)在这5分钟内,用N2来表示的平均反应速率是多少?
(5)平衡时氢气的浓度是多少?
碱式碳酸镁[Mgx(CO3)y(OH)z•nH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: 。
②氢氧化镁浆液与CO2反应的化学方程式为: 。
③碱式碳酸镁用乙醇洗涤的目的是: 。
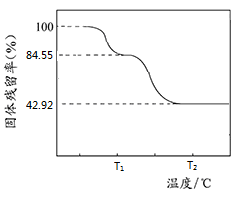
(2)某同学将4.66g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重1.76g。样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是 g)
求:
(1)加入NaOH溶液0--20mL过程中反应方程式为:______。
160--180mL过程中反应方程式为_______________________。
(2)合金中Mg的质量为____________g。所用HCl 的物质的量浓度为____________mol/L。
将标准状况的NO2、NH3、N2组成的混合气体10L,通过稀HNO3溶液,溶液的质量增加了12.5g,气体的体积缩小到3.28L。求混合气体各成分的体积。
把2.0 mol/L Fe2(SO4)3溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:
(1)混合液中Fe3+的物质的量浓度 ;
(2)混合液中SO42—的物质的量浓度 ;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余,求此时溶液中FeSO4的物质的量浓度 。
试题篮
()