(本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
(本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
((1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) −c (M+)= mol·L-1,c (H+) −c (MOH) = mol·L-1。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH7(填“>、<或=”)。
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中离子浓度由大到小的顺序是 。
(本题共14分)
多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得。不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙。
3Ca(OH)2+8S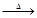 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S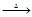 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
52.硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x = 。
53.取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解。原理如下: Sx2—+2H2O+2CO2→(x—1)S↓+H2S↑+2HCO3—;S2O32—+ H2O+CO2→HSO3—+HCO3—+S↓完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 。(答案用小数表示,保留2位有效数字)
54.如果把生石灰、硫磺和水按质量比7∶16∶70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 。
55.现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推理过程)。
(8分)取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀。另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示。试回答下列问题: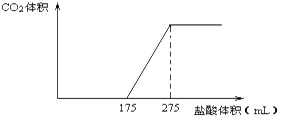
(1)加入盐酸后总共产生的气体在标准状况下的体积为__________________L;
(2)盐酸中HCl的物质的量浓度__________________;
(3)反应后的固体的成分(填化学式)__________________;
(4)x=_____________。
(本题共14分)已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2 2CuO
2CuO 4NO2↑
4NO2↑ O2↑开始分解,至250℃分解完全。(其中2NO2
O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO
2NO O2等反应忽略不计)。
O2等反应忽略不计)。
800℃时,4CuO 2Cu2O
2Cu2O O2↑ 开始分解,至1000℃以上分解完全。
O2↑ 开始分解,至1000℃以上分解完全。
54.取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;将吸收液加水稀释到100mL,此溶液中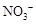 的物质的量浓度为 。
的物质的量浓度为 。
55.取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O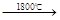 4Cu
4Cu O2↑
O2↑
56.取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
57.取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O) n (Cu)
n (Cu)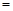 x。将此混合物溶于足量的稀硫酸中(Cu2O
x。将此混合物溶于足量的稀硫酸中(Cu2O 2H
2H
 Cu
Cu Cu
Cu
 H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
(7分)取含MnO2的软锰矿石27.86g跟足量浓盐酸反应(杂质不参与反应),制得17.75gCl2,求(1)这种软锰矿石中MnO2的百分含量。 (2)求被氧化的HCl的质量。
在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉(不考虑反应前后溶液体积的变化)。反应开始至2min末收集到氢气1.12L(标准状况下),在此之后,又经过4min铁粉全部溶解,则:
⑴在前2min内用FeCl2表示的平均反应速率为多少?
⑵在后4min内用HCl表示的平均反应速率为多少?
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。求
①混合物中Cu的质量
②产生的NO在标准状况下的体积
(8分) 将N2和 H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5 mol该混合气体通入密闭容器内,使之发生反应,并在一定条件下达到平衡,已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍。试求:
(1)反应前混合气体中N2和 H2的体积比。
(2)达平衡时混合气体中氨的物质的量。
在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1。请回答:
xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1。请回答:
(1)x的值为_______
(2)A的转化率为α(A)%=______________
(3)此温度下该反应的平衡常数K=
在标准状况下,用一定量的水吸收氨气后得到浓度为12.0mol/L密度为0.915g·cm-3的氨水,试计算(要求写出计算过程):
(1)该氨水溶质的质量分数ω是多少?(用百分数表示,保留到小数点后一位数)
(2)1L水吸收标准状况下的氨气多少升可制得上述氨水?(水的密度以1.00g·cm-3计,计算结果取整数。)
(6分) 化工厂常用氨水检验管道是否漏气,其反应式为3Cl2+8NH3=6NH4Cl+N2,当有160.5克NH4Cl产生时,被氧化的氨气是多少克?反应的氯气的体积为多少(标准状况下)?
试题篮
()