溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
如图为a、b两物质的溶解度曲线,请依图回答下列问题: 
(1)M点的含义为 。
(2)要想从a物质的溶液中获得较多a晶体,最好用 _ 法。
(3)在80℃时,将30g a物质投入100g水中,得到的溶液 (填“是”或“否”)饱和。若不饱和,可用什么方法使其变为饱和溶液?请说出两种的方法:① ;② 。
下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度 g/100g水 |
NaCl |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
(1)20℃时,氯化钠的溶解度为 ;
(2)要配制一定溶质质量分数的氯化钠溶液时,溶解过程所需要的仪器有 ;
(3)现有操作步骤:a.溶解 b.加热浓缩 c.降温结晶 d.过滤;若KNO3晶体中含有少量NaCl,提纯KNO3的操作步骤是(填序号) ;
(4)60℃时,100g KNO3饱和溶液恒温蒸发10g水,会有 g硝酸钾晶体折出;
(5)向l00g 10%的KNO3溶液中加入12.5g KNO3固体,完全溶解后,所得溶液中溶质质量
分数为____________。
向装有等量水的A、B、C烧杯中加入10g、20g、25g的NaNO3固体,充分溶解后,现象如图一所示:
(1)A、B、C烧杯中溶液一定属于饱和溶液的是_______(填标号);
(2)图二中能表示NaNO3溶解度曲线的是______(填“甲”或“乙”);
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是_________________________;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的质量是______(填标号)。
A.甲=乙 B.甲>乙 C.甲<乙 D.无法判断
下图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 。
(2)t2℃时,30g a物质加入到50g水中不断搅拌,能形成80g溶液吗? (填“能”或“不能”)。
(3)将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,溶液中溶质的质量分数由大到小的顺序是 。
(4)若将a物质从a和少量b的混合溶液中分离出来,宜采用的提纯方法是 。
(5)要使c物质的接近饱和的溶液变成饱和溶液,可采用的一种方法是 。
向装有等量水的A、B、C烧杯中分别加入5g、6g、6g某固体X,充分溶解后,现象如图一所示。
(1)烧杯中的溶液一定属于饱和溶液的是 (填序号)。
(2)图二能表示固体X溶解度曲线的是 (填“甲”、“乙”或“丙”)。
(3)甲溶液中混有少量丙,采用 方法可以得到比较纯的甲。
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的 (填序号)
①所含溶剂质量:甲<乙 ②甲、乙都是饱和溶液
③溶液质量:甲>乙 ④溶质质量分数:甲>乙.
下图是A、B两种固体物质的溶解度曲线。据图回答:
(1)P点表示的意义是 。
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是 。
(3)当A中含有少量B物质时,可采用 的方法提纯A物质。
(4)t2℃时,将90gA物质投入到100g水中,得到A物质的 (填“饱和”或“不饱和”)溶液,此时溶液的质量是 g。
(5)t2℃时,将30gA物质投入到100g水中,可再采取哪些具体措施,使之变为饱和溶液? 。
甲、乙两种固体物质的溶解度曲线如图所示。
⑴图中P点的含义是 。
⑵40℃时,饱和溶液中溶质的质量分数:甲 乙(填“>”、“=”或“<”)。20℃时,将50 g乙物质放入100 g水中,所得溶液中,溶解的溶质与溶剂的质量比为 (用最简整数比表示)。
⑶20℃时,进行了如下图所示的实验:
上述实验过程中所得的溶液,属于不饱和溶液的是 (填写序号,2分), 溶液与B溶液中溶质的质量分数相同。
下图是某固体物质的溶解度曲线图,根据曲线回答:
(1)t1℃,50克水中,最多能溶解该物质的质量为 g。
(2)t2℃时,该物质的溶解度为 。
(3)B点对应的溶液是否为t3℃的饱和溶液 (填“是”或“否”)。
(4)要使该物质的饱和溶液变为不饱和溶液,可采用的一种方法是 。
下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: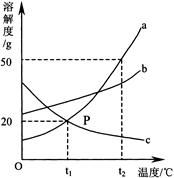
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,形成的是 (填“饱和”或“不饱和”)溶液,所得溶液质量为 g。
(3)a中混有少量的b,若要从混合液中分离出a可采用的方法是 。
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是 。
下图是固物质体甲的溶解度曲线。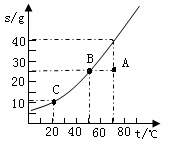
(1)图中A点代表甲的___________溶液(选填“饱和”或“不饱和”)。
(2)请填写下表剩余的空格(在表中的第1、2、3栏内选填“变大”、“变小”或“不变”)。
| |
1 |
2 |
3 |
4 |
| 降低温度 |
溶剂质量 |
溶质质量 |
溶质质量分数 |
溶液状态 |
| A→B |
|
|
不变 |
B点 |
| B→C |
不变 |
|
|
C点 |
(10株洲26).(4分)如图是A、B两种物质的溶解度曲线,请回答: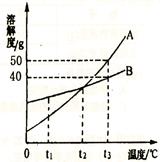
(1)t3℃时,把46g固体A放入100g水中,充分溶解后可得到A的 溶液(填“饱和”或“不饱和”)。
(2)t1℃时,A、B两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把tl℃时A、B的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B:若把t3℃时A、B的饱和溶液分别降温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B。
20℃时,将等质量的甲、乙两种固体物质,分别加人到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题: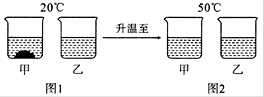
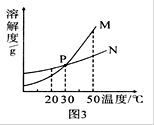
(1)图1中一定为饱和溶液的是 _______。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为________________。
(3)图3中表示乙的溶解度曲线是________;
水是重要的资源。
(1)活性炭常用于净水,其作用是 。
(2)海水晒盐得粗盐,粗盐提纯的实验步骤为:溶解、 、蒸发结晶。
(3)水是一种重要的溶剂,(如图1)是硝酸钾和氯化钠的溶解度曲线。
①图中A点表示的含义是 。
②20℃,向50g水中加入25g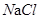 ,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
,得到 溶液(填“饱和”或“不饱和”);若要增大该溶液中溶质的质量分数,其方法是 。
(4)水在化学实验中具有重要作用,将光亮的铁丝固定在U型管左端的塞子上(如图2),几天后,观察到的实验现象为 ;从实验中可以得出铁生锈的条件是 。
2012年3月22日是第二十届“世界水日”。水与人类的生活和生产密切相关。
(1)下列做法有助于保护水资源的是 。
A.禁止向河流中排放废水
B.禁止向乱扔垃圾
C.节约用水
(2)水的硬度过大会影响生产和生活,区分软水和硬水常用的物质是 。生活中可以通过________的方法来降低水的硬度。
(3)自来水厂净水过程为:天然水→加絮凝剂→沉降→过滤→吸附→加消毒剂→自来水。通常使用的絮凝剂是 ;X是一种新型的自来水消毒剂,制取X的化学方程式为:C12+2NaClO2=2NaCl+2X,则X的化学式为 。
(4)下图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。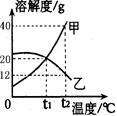
①溶解度随温度升高而增大的物质是 (填“甲”或“乙”);t1℃时,甲的溶解度_______乙的溶解度(填“大于”或“小于”或“等于”)。
②某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。
在溶液A、B、C中,属于饱和溶液的是___________;与溶液C质量相等的是______。
在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为______。
试题篮
()