下图为A、B两种不含结晶水的固体物质的溶解度曲线。下列说法不正确的是
A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.等质量的A和B的饱和溶液从30℃降到20℃时,B析出的晶体最多。
D.10℃时,等质量的A和B饱和溶液中,B的溶剂量最少
溶解度是物质溶解性的定量表示,溶解度曲线可表示物质在不同温度下的溶解度。甲、乙两种物质的溶解度曲线如图所示,根据图示回答下列问题:

(1)甲、乙两种物质中溶解度受温度影响较大的是 物质。
(2)若甲物质中混有少量的乙物质,提纯甲物质最好采取的方法是 (填“降温结晶”或“蒸发结晶”)。
(3)t2℃时,乙物质的溶解度为 g;t2℃时,若将30g乙物质加入到50g水中,所得溶液的溶质质量分数是 (计算结果精确到0.1%)。
(4)将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,所得甲物质溶液的溶质质量分数 乙物质溶液的溶质质量分数(填“大于”“小于”“等于”之一)。
在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1:
判别依据:
方案2:
判别依据:
人类的日常生活和工农业生产离不开水。请回答:
(1)水(填"属于"或"不属于")人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做(填"软水"或"硬水")。
(3)下列净化水的单一操作中,相对净化程度较高的是(填字母)
| A. |
静置沉淀 |
B. |
吸附沉淀 |
C. |
蒸馏 |
(4)水在通电的条件下可以分解,写出该反应的化学方程式。
(5)甲和乙两种固体物质的溶解度曲线如下图所示,回答下列问题:

①在℃时,甲和乙两种物质的溶解度相等。
②将
℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是(填"甲"或"乙")。
③
℃时,将60
甲物质放入100
水中,充分搅拌,所得溶液的溶质质量分数
(甲)与同温下乙物质的饱和溶液的溶质质量分数
(乙)大小关系为(填字母)。
| A. |
(甲)< (乙) |
B. |
(甲)> (乙) |
C. |
(甲)= (乙) |
D. |
无法确定 |
如图是甲、乙两种固体的溶解度曲线.下列说法中不正确的是
| A.t1℃时,甲和乙的溶解度相等 |
| B.t1℃时,30g乙加到100g水中形成饱和溶液 |
| C.t2℃时,各100g饱和溶液降温至t1℃析出固体甲多于乙 |
| D.t2℃时,75g甲的饱和溶液中加100g水得到20%的溶液 |
下表为两种物质在不同温度时的溶解度
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/ | 27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
56.7 |
|
| 13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
请回答:
(1)60 ℃时,
的溶解度是
;
(2)40 ℃时,将30
加入到50
水中,充分溶解后所得溶液是溶液(填写"饱和"或"不饱和");
(3)将20 ℃时
和
的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:
(填写">"、"<"或"=")。
下表列出了KNO3与NaCl在不同温度时的溶解度:
| 温度(℃) |
0 |
10 |
20 |
40 |
60 |
80 |
100 |
| KNO3的溶解度(g) |
13.3 |
20.9 |
31.6 |
63.9 |
110 |
169 |
246 |
| NaCl的溶解度(g) |
35.7 |
35.8 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
(1)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失).
①向混合物中加入适量水,加热溶解;
②继续加热溶液至100℃并恒温蒸发浓缩;
③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥.
A.步骤②中,为确保没有晶体析出,溶液中至少要保留 g水;
B.步骤③中,最多可得到KNO3晶体 g;
C.根据上述实验可概括出除去KNO3中少量NaCl的主要步骤:加热溶解→蒸发浓缩→ →过滤→洗涤→干燥;
D.洗涤时,应选用少量 (选填“热水”或“冷水”).其目的是: ;
(2)除去NaCl中少量KNO3的一种方法是:将NaCl和KNO3的混合物置于适量水中,加热,搅拌,待KNO3全部溶解,趁热过滤,将过滤所得的NaCl晶体进行洗涤和干燥.上述方法中,趁热过滤的目的是: .
(3)取23.4gNaCl和40.4gKNO3,加70g水,加热溶解.在100℃时蒸发掉50g水,维持该温度过滤,得到的晶体质量为 g;将滤液冷却至10℃,充分结晶,写出析出的晶体的化学式: .
下图是甲、乙两种固体物质的溶解度曲线。下列说法错误的是

| A. | 时,甲、乙两物质的溶解度相等 |
| B. | 乙的饱和溶液降温时,溶质质量分数保持不变 |
| C. | 甲中混有少量乙,可采用降温结晶的方法提纯甲 |
| D. | 时,甲的饱和溶液溶质质量分数为20% |
如图所示,
、
、
为三种物质的溶解度曲线,请根据图示信息回答下列问题。

(1)
℃时,
、
、
三种物质中溶解度最小的是。
(2)
℃时,将20
物质投入100
水中,充分溶解,温度不变,所得溶液为溶液(填"饱和"或"不饱和")。
(3)下列说法正确的是。
| A. |
℃时,将 和 的混合溶液(两者均已达到饱和),降温到 ℃,析出的晶体含有 和 |
B. | 从混有少量 的 物质中提取较纯净的 ,可通过冷却它们的热饱和溶液实现 |
| C. |
℃时,将 、 、 的饱和溶液分别降温到 ℃,所得溶液中溶质质量分数的大小关系是 > > |
D. | ℃时,欲用 的饱和溶液配制10%的 溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器 |
(4)如图所示,向放有镁条的试管中滴加稀盐酸后,锥形瓶中
的饱和溶液变浑浊。请解释原因。

、
、
三种固体物质在水中的溶解度曲线如图所示,请回答:

(1)℃时,
、
两种物质在100
水中达到饱和状态时溶解的质量相等;
(2)若
中混有少量的
,最好采用的方法提纯
;
(3)现有接近饱和的
物质溶液,使其变成饱和溶液的方法有:①加入
物质;②恒温蒸发溶剂;③;
(4)
℃时将20
物质放入50
水中,充分搅拌,所得溶液中溶质的质量分数是;
(5)将
℃时等质量的
、
、
三种物质的饱和溶液降温至
℃时,所得溶液的质量由大到小的顺序是。
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
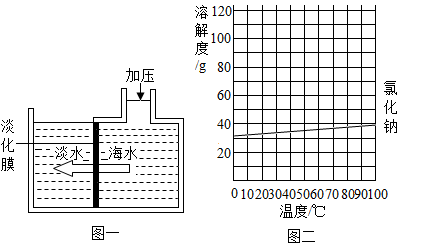
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
甲、乙、丙三种固体物质的溶解度曲线如图所示.下列叙述错误的是()
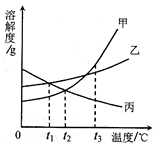
| A. | 时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量:甲>乙 |
| B. | 将 时甲、丙的饱和溶液升温到 ,两种溶液中溶质的质量分数相等 |
| C. | 将 时甲的饱和溶液变为 时甲的饱和溶液,可以采用蒸发水的方法 |
| D. | 将 时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量:甲>乙>丙 |
20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示。

请回答下列问题:
(1)图1中一定是饱和溶液的是溶液(填"甲"或"乙");图2中乙溶液一定是溶液(填"饱和"或"不饱和")。
(2)图3中表示乙的溶解度曲线的是(填"M"或"N");图2中乙溶液降温至30℃析出晶体(填"会"或"不会")。
(3)50℃时甲的饱和溶液中溶质质量分数为(计算结果精确到0.1%)。
如图1是a、b、c三种物质的溶解度曲线,回答下列问题:

(1)P点的含义是。
(2)
时,将50g a物质放入50g水中充分溶解得到溶液的质量为g。
(3)将
时,a、b、c三种物质的饱和溶液降温至
,所得溶液中溶质的质量分数由大到小的顺序是
(4)
时,将盛有c的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是 。
如图是甲、乙、丙三种物质的溶解度曲线。下列说法错误的是

| A. | 时,三种物质的溶解度是丙>乙>甲 |
| B. | 时,甲和丙的饱和溶液溶质质量分数相等 |
| C. | 三种物质的溶解度均随温度的升高而增大 |
| D. | 当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯 |
试题篮
()