从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用

(1)明代科学著作《天工开物》中记载:
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。生铁属于 材料。上述描述中利用铁的 (选填序号)。
| A. |
a.导热性 |
| B. |
b.导电性 |
| C. |
c.硬度大 |
②“泥固塞其孔,然后使水转釉”是指高温下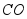 将红砖中的
将红砖中的 转化为
转化为 而形成青砖。该转化的化学方程式为 。
而形成青砖。该转化的化学方程式为 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁( )不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
)不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在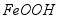 ,从而证明火星表面曾经存在过水,其理由为 。
,从而证明火星表面曾经存在过水,其理由为 。
③活性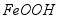 可除去石油开采过程中的有害气体
可除去石油开采过程中的有害气体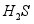 ,并获得
,并获得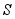 ,原理如下。
,原理如下。
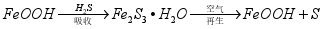
吸收中生成的另一种物质的化学式为 ,再生时发生反应的化学方程式为 。
(二)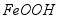 的制备
的制备
用废铁屑(主要成分为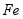 ,含少量
,含少量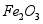 和
和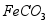 )制备
)制备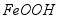 主要流程如下。
主要流程如下。
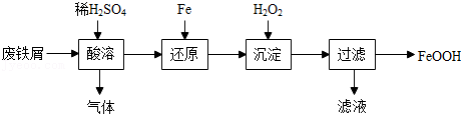
(1)酸溶时适当提高反应温度和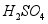 浓度,目的是 ,产生的气体为 。
浓度,目的是 ,产生的气体为 。
(2)还原发生的反应为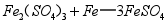 。
。
沉淀发生的反应为 。
。
沉淀时反应温度不宜太高,原因是 。
(3)沉淀时会有部分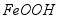 与
与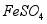 反应生成
反应生成 ,反应的化学方程式为 。
,反应的化学方程式为 。
(三)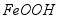 的含量测定
的含量测定
已知: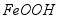 及铁的氧化物加热分解的温度如下。
及铁的氧化物加热分解的温度如下。

称取含 的
的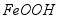 样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
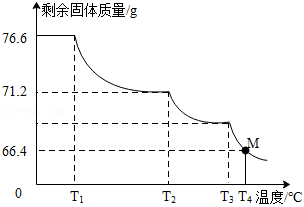
(1)样品中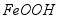 的含量为 %(精确到0.1%)。
的含量为 %(精确到0.1%)。
(2)当加热到 时,M点固体的成分是 ,对应的质量比为 。
时,M点固体的成分是 ,对应的质量比为 。
通过一年的化学学习,我们学会了从微观角度认识物质。
(1)如图是部分原子的结构示意图请回答问题:
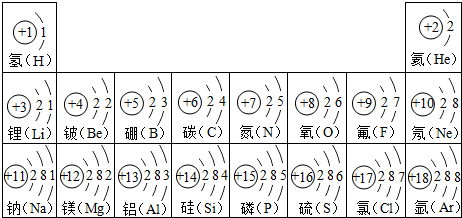
①化学上将质子数为 的所有氯原子统称为氯元素。
②8号元素和地壳中含量最多的金属元素组成的化合物中,金属元素的化合价为 。
③在化学反应中,11号元素的原子易 电子。
(2)如图是氢气在氯气中燃烧生成氯化氢的微粒示意图。
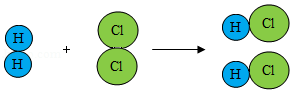
请据图回答:
①氢气可压缩储存于钢瓶中,因为受压时氢气分子之间的 减小。
②从微观的角度解释该化学变化的实质是 。
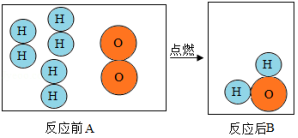
如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于 (填物质分类),从微观角度说明理由是 ;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图 .
一班的同学在探究金属镁的化学性质时发现,将镁条放到盛有冷水的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(1)小明认为,据此现象可断定加热时镁能和水反应,小强认为小明的结论不正确,理由是 。
(2)小明向加热的试管中滴入酚酞溶液,溶液显红色,证明镁在加热时 (填“能”或“不能”)与水发生反应
(3)小明将加热后的试管放置在空气中一段时间后,同学们发现溶液中的红色消失了。
在确定酚酞溶液没有变质的情况下,请你根据初中所学化学知识,对溶液中红色消失的原因做出合理猜想。
猜想一:
猜想二:
请设计实验方案,对其中一种猜想进行验证 。(只需答出实验方案,不需要回答现象和结论)
绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩黏土高温煅烧得到一种新型水泥熟料,主要反应为: 。
(1)上述反应涉及四类化合物中的哪几类? 。
(2) 的化学式可表示为 ,含 44.8%的水泥熟料中含 的质量分数为 。
(3)在实验室用如图所示方法粗略测定石灰石中 的质量分数,无需测定的数据是 (填序号)。
| A. |
取用石灰石样品的质量 |
| B. |
倒入的过量稀盐酸的质量 |
| C. |
盐酸接触样品前电子秤的读数 |
| D. |
反应停止后电子秤的读数 |
(4)用含 90%的石灰石1000t生产新型水泥熟料,理论上会排放 多少吨?(无计算过程不给分)

根据如图图示回答下列问题:
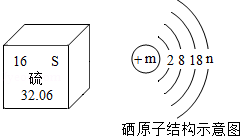
①从图中不能直接获取的信息是 。
A.硫属于非金属元素 B.硫的核外电子数为16
C.硫的相对原子质量为32.06 D.硫元素形成的单质有还原性
②根据硫原子的最外层电子数,推出硫元素的最低化合价为﹣2价,则硫元素的最高化合价为 价。
③元素周期表中同一主族的元素具有相似的化学性质,例如硒(Se)和S有相似的化学性质,则图中m= 。
自然界的水都是含有多种物质的混合物,生产、生活中需要的纯净水可以通过蒸馏得到。
(1)将刚刚蒸馏出来的蒸馏水盛放在敞口的干净容器里,一段时间后,蒸馏水的pH将发生怎样的变化?
请你分析说明引起蒸馏水pH改变的原因。
(2)在电解水的实验中,为了增加水的导电性,常在水中加入一定量的稀硫酸。某次实验时,在一定量的蒸馏水中加入50克16%的稀硫酸进行电解,结束后测得剩余溶液的质量为100克,则剩余溶液中溶质的质量分数为多少?
【2015年江苏省苏州市】二氧化硫是一种无色具有刺激性气味的气体,它进入大气后可形成硫酸型酸雨。
(1)煤、石油、木柴中都含有硫元素,点燃后均会产生二氧化硫气体,可用 溶液检验该气体的存在。
(2)为减少大气污染,火力发电厂采用以下两种方法吸收废气中的二氧化硫。
①用氨水吸收废气中的二氧化硫,其反应原理可用化学方程式表示为 。已知:亚硫酸盐不稳定,易被空气中的氧气氧化成硫酸盐。
②用石灰石浆吸收废气中的二氧化硫,其反应原理是:
2CaCO3+O2+2SO2 2CaSO4+2CO2 。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?
2CaSO4+2CO2 。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?
根据表中信息,请回答下列问题。
测试类别 S化合价 |
氢化物 |
单质 |
① |
酸 |
盐 |
+6 |
﹣ |
﹣ |
3 |
24 |
2444424 |
② |
﹣ |
﹣ |
2 |
23 |
23 |
0 |
﹣ |
S |
﹣ |
||
﹣2 |
2S |
﹣ |
﹣ |
2S |
2S |
(1)填写表中内容:① ;② 。
(2)物质可以按照一定规律发生转化,请按要求各写出一个对应的化学方程式。
①置换反应 ;②复分解反应 。
424是农业上常用的铵态氮肥,在实验室检验其为铵态氮肥的实验操作是______(写出一种即可)
222O,反应前后硫元素化合价发生的变化是
(5)在实验室中,可用热的碱液除去试管内壁上附着的硫,请完成该反应的化学方程式: S+ NaOH═ 23+ + 2O。
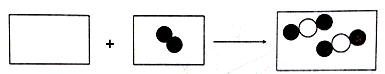
【2015年重庆市B】(学习化学后,我们学会了从微观角度认识物质。
(1)已知碳原子和氧原子的结构示意图分别为: 两种原子中相等的是 (填序号)。
两种原子中相等的是 (填序号)。
| A.质子数 | B.电子数 | C.第一层电子数 | D.第二层电子数 |
(2)保持一氧化碳化学性质的粒子名称是 。
(3)下图是一氧化碳与氧气反应的微观模型图,请在下图方框中以图示的方式完成该化学反应的微观过程(图中 表示氧原子,Ο表示碳原子)。
表示氧原子,Ο表示碳原子)。
根据下列装置图,回答有关问题:
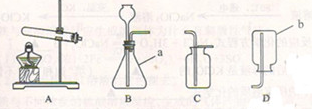
(1)写出装置图中标号仪器的名称:a____________;b____________。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式:__________________________。可选用的收集装置是________(填字母)。
(3)写出实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式_________________________。可选用的发生装置是________(填字母)。
(4)实验室将A装置加以改动,在高温下使碳酸钙分解生成氧化钙和二氧化碳。按此反应,试计算工业上要制取5.6t氧化钙,理论上需要含碳酸钙80%的石灰石的质量是多少?(写出计算过程)
【2015年四川省泸州市】过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
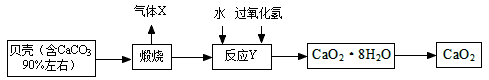
(1)气体X是CO2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应Y需控制温度在0~5℃,可将反应容器放在 中,该反应是化合反应,反应产物是CaO2·8H2O,请写出化学方程式 。获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是 。
(3)CaO2的相对分子质量为 ,过氧化钙晶体﹝CaO2·8H2O﹞中H、O元素的质量比为 。
(4)为测定制得的过氧化钙晶体中CaO2·8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220℃充分反应(方程式为2CaO2·8H2O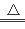 2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
2CaO+O2↑+16H2O↑,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2·8H2O的质量分数(CaO2·8H2O相对分子质量为216),写出必要的计算过程。
某同学以金泥(含有 等)为原料制备( )和 的流程如图所示:
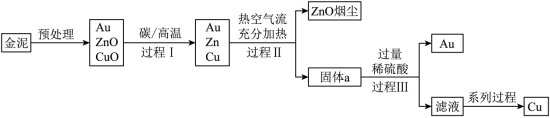
琴琴同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将 转化为氧化物,并完全分离出 烟尘。
(1)“预处理”中会产生 ,若 直接排放会导致______。
(2)“过程Ⅱ”产生的固体 中,除 外一定还有的物质是______。
(3)“过程Ⅲ”分离 的操作是______,加入过量稀硫酸的目的是______。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为______,该反应属于______反应(填写基本反应类型)。
(5) 烟尘可用 溶液吸收,该反应生成偏锌酸钠( )和 的化学方程式为______。
科学探究离不开实验活动。
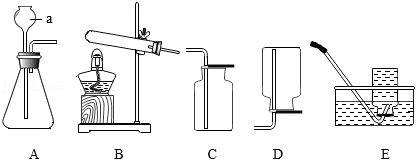
(1)仪器a的名称是 。
(2)实验室用加热高锰酸钾的方法制取氧气,并用于进行铁丝在氧气中燃烧的实验,最好选用的发生装置和收集装置是 。
(3)向装置A中加入少量氧化铜作催化剂,再向其中加入68g过氧化氢溶液,反应结束后,共产生1.6g氧气,写出该反应的化学方程式 ,所用过氧化氢溶液的溶质质量分数为 。
(4)实验小组同学用石灰石和6%的稀盐酸制取 时,发现固体仍有大量剩余,但不再产生气泡,请写出一种可能的原因 ,并设计实验进行验证 。
(5)以下反应均可生成 (极易溶于水,密度比空气小):
①
②
③
结合以上装置,适合作为实验室制取 的反应原理有 (填序号)。
图1是某兴趣小组在学习碱的性质时进行的探究活动,请要求回答问题。
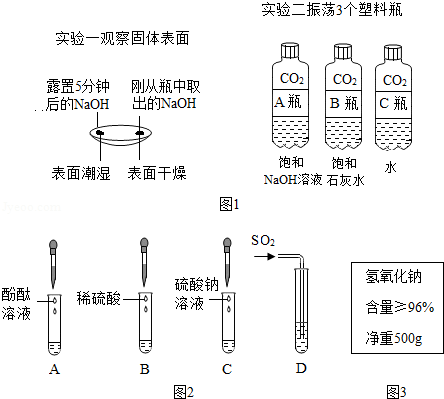
(1)通过分析实验一可知,氢氧化钠会吸收空气中的 。
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起 作用。
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀。
①写出D试管中反应的化学方程式 。
②不同的碱溶液中都含有OH﹣,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是 (填字母序号)
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究。
【提出问题】
【提出猜想】
猜想I:查阅资料可知,工业用氢氧化钠可能含有NaCl。
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是 (用简洁的文字表述)。
【进行实验】
实验步骤 |
实验现象 |
解释或结论 |
①取适量固体样品于试管中,加水溶解 |
固体全部溶解 |
/ |
②向①所得溶液中滴加过量的 |
一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 |
样品中含有Na2CO3 |
③向②所得溶液中滴加几滴硝酸银溶液 |
产生白色沉淀 |
样品中还含有NaCl.反应的化学方程式为 |
试题篮
()