已知25℃时0.1mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中_________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1的醋酸溶液中加入少量下列物质中的_________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(3)若_________(填“甲”或“乙”)的解释正确,溶液的pH应_________(填“增大”“减小”或“不变”)。(已知25℃时,CH3COONH4溶液呈中性)
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有_________种粒子。
②溶液中有两种粒子的物质的量的和一定等于0.010mol,它们是_________和_________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
已知IBr、SiCl4、PCl3、CH3COCl、CH3COOOCCH3常温下很容易与水反应,反应方式与盐类水解类似。
(1)在所给5种物质与水反应的产物中,属于最高价氧化物对应水化物的是________,属于无氧酸的是________。
(2)分别将0.01mol这5种物质放入0.1L水中反应,结果使溶液的pH接近3的是________。
已知某溶液中只存在OH-、H+、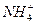 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(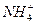 )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c(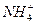 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(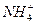 )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(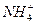 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)________c(OH-)。
实验室有下列试剂:①NaOH溶液②水玻璃③Na2S溶液④Na2CO3溶液⑤NH4Cl溶液⑥澄清石灰水⑦浓H2SO4,其中必须用带橡胶塞的试剂瓶的是()
| A.①⑥ | B.①②③④⑥ |
| C.①②③⑥ | D.①②③④ |
下列粒子在溶液中能大量共存的是()
A.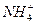 、Fe2+、 、Fe2+、 、 、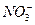 |
B.Fe3+、K+、Cl-、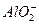 |
C.Al3+、Na+、 、HS- 、HS- |
D.Ca2+、H+、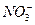 、 、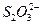 |
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是()
| A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N-3)>c(OH-) |
| B.HN3与NH3作用生成的叠氮酸铵是共价化合物 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N-3)>c(OH-)>c(H+) |
D.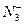 与CO2含相等电子数 与CO2含相等电子数 |
下列混合溶液中,各离子浓度的大小顺序正确的是()
A.10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合:c(Cl-)>c(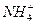 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
| B.10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| D.10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
常温下pH=2的一元弱酸HA溶液,其电离百分率为5%,0.01mol·L-1的一元碱BOH溶液中, =1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
=1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
| A.c(OH-)>c(H+)>c(B+)>c(A-) | B.c(B+)=c(A-)>c(H+)>c(OH-) |
| C.c(B+)>c(A-)>c(H+)>c(OH-) | D.c(A-)>c(B+)>c(H+)>c(OH-) |
常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是()
| A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
下列操作,能使电离平衡H2O H++OH-向右移动,且溶液呈酸性的是()
H++OH-向右移动,且溶液呈酸性的是()
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3溶液 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s) Ca2++2OH-,向其中加入少量下列溶液可使Ca(OH)2减少的是()
Ca2++2OH-,向其中加入少量下列溶液可使Ca(OH)2减少的是()
| A.Na2S溶液 | B.AlCl3溶液 |
| C.NaOH溶液 | D.CaCl2溶液 |
等体积的下列溶液,阴离子的总物质的量浓度最大的是()
| A.0.2mol·L-1K2CO3 |
| B.0.1mol·L-1Ba(OH)2 |
| C.0.2mol·L-1NaCl |
| D.0.2mol·L-1(NH4)2SO4 |
下列有水参加的反应中,不属于盐类水解反应的是()
A. +H2O +H2O NH3·H2O+H+ NH3·H2O+H+ |
B.Al3++3H2O Al(OH)3+3H+ Al(OH)3+3H+ |
C. +2H2O +2H2O Al(OH)3+OH- Al(OH)3+OH- |
D. +H2O +H2O H3O++ H3O++ |
试题篮
()