下列溶液中各微粒的浓度关系正确的是
A.0.2 mol/L的CH3COOH溶液与0.1 mol/L CH3COOH溶液中c(H+)之比为2:1
B.0.1 mol/L NaHCO3溶液中,c(Na+) = 2c(CO32—) + c(HCO3—) + c(H2CO3)
C.0.1 mol/L 的NaHA溶液,其pH = 4,则c(HA—)>c(A2—)>c(H2A)
D.只含Na+、CH3COO—、H+、OH—的酸性溶液中,c(H+)>c(CH3COO—)>c(Na+)>c(OH—)
根据下表信息,判断0.10mol/L的下列各溶液pH值最大的是
|
|
某溶液中含有NH4+、H+、SO42-和OH-,对该溶液的描述一定正确的是 ( )
| A.该溶液可能呈酸性,也可能呈碱性或中性 |
| B.只能是硫酸铵和硫酸的混合溶液 |
| C.离子浓度由大到小的顺序是:c(NH4+)>c(SO42-)>c(H+)>e(OH一) |
| D.离子浓度存在下列关系:c(NH4+)+c(H+)=c(OH一)+c(SO42-) |
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H="+571.2" kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=—1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g)△H=—460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入CO2气体至溶液增重8.8g。有关该溶液说法正确的是 ( )
| A.溶质为Na2CO3 |
B.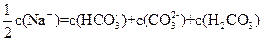 |
C. |
D.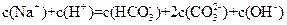 |
某混合溶液中所含离子的浓度如下表,则Mn+离子及a值可能为 ( )
| 所含离子 |
NO-3 |
SO2-4 |
H+ |
Na+ |
Mn+ |
| 浓度(mol·L-1) |
3 |
1 |
2 |
1 |
a |
| A.Mg2+、1 | B.Ba2+、0.5 | C.Al3+、1.5 | D.Fe2+、2 |
在一定条件下,Na2CO3溶液存在水平平衡:CO2-3+H2O  HCO-3+OH-。下列说法正确的是 ( )
HCO-3+OH-。下列说法正确的是 ( )
| A.稀释溶液,上述可逆反应平衡常数不变 |
| B.通入CO2,溶液pH增大 |
| C.加入NaOH固体,平衡向正反应方向移动 |
D.升高温度, 不变 不变 |
物质的量浓度、体积都相同的NaF和NaCN溶液中,离子总数的关系正确的是(已知HF比HCN易电离)
| A.NaF=NaCN | B.NaF>NaCN | C.NaF<NaCN | D.无法确定 |
草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述正确的是
| A.c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B.c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C.c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D.c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
根据化学平衡知识,判断下列 说法正确的是( )
说法正确的是( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生
D.常温下,稀释0.1 mol/L的氨水,溶液中所有离子浓度均下降
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,按溶液pH由小到大排列正确的是( )
| A.④①②③⑤ | B.④①②⑤③ | C.①④②③⑤ | D.①④②⑤③ |
下列溶液中微粒的物质的量浓度关系一定正确的是
| A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| B.等物质的量的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.pH=2的HA溶液与pH=12的MOH溶液等体积混合: c(M+)=c(A-)>c(OH-)=c(H+) |
| D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-) |
土壤是人类从事农业、林业生产的一项重要资源。保护土壤防止污染、合理利用土壤是我们每个人的职责。请回答问题。
(1)有人说,电动自行车的发展,可能是环保背后的更大污染。这一说法的原因是
。
(2)农作物的生长对于土壤的酸碱性有一定的要求,有的喜酸性,有的喜碱性。适于一般农作物生长的PH在6.5-7.5之间,酸性或碱性过强都不利于作物的生长。土壤的碱性主要是由于土壤中的 、
、 等盐类的水解而产生,请用离子方程式表示
等盐类的水解而产生,请用离子方程式表示 、
、 的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
(3)土壤里发生着大量的氧化还原反应,许多氧化还原反应是在微生物存在的条件下进行的。如当土壤通气性良好时,土壤团粒的空隙里含有氧气,这时,在好气性微生物的作用下氧化反应得以顺利进行,土壤里的 等被氧化为
等被氧化为 等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
试题篮
()