下列反应中,水作氧化剂的是 ( )
| A.2Na2O2+2H2O===4NaOH+O2↑ | B.C+H2OCO+H2 |
| C.Cl2+H2O===HCl+HClO | D.2F2+2H2O===4HF+O2 |
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A.NaNO2是氧化剂 |
| B.N2既是氧化剂,又是还原剂 |
| C.NH4Cl中的氮元素被还原 |
| D.每生成1mol N2时,转移电子的物质的量为6mol |
下列叙述中,正确的是( )
| A.含金属元素的离子不一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定做氧化剂 |
| C.元素从化合态变为游离态时,该元素一定被还原 |
| D.原子失电子数越多还原性越强 |
已知:Ni +CuSO4=NiSO4+Cu Cu+2AgNO3=Cu(NO3)2+2Ag 则下列判断正确的是
| A.还原性:Ni>Cu>Ag | B.氧化性:Ni2+ > Cu2+ >Ag+ |
| C.还原性:Ni<Cu<Ag | D.氧化性:Ni2+ < Cu2+ <Ag+ |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→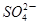 +4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:
+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:
Cl2+2e-→2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.ClO2 | C.HClO | D.NaClO4 |
下列比较中,正确的是
| A.原子半径:Na>Mg | B.碱性:NaOH>KOH |
| C.结合H+的能力:CO32¯<Cl¯ | D.还原性:I¯<Br¯ |
根据下列反应(1)Cl2+ 2KBr==2KCl+ Br2,(2)Br2 + 2KI==2KBr +I2,判断单质的氧化性由强到弱的顺序是( )
| A.Br2> I2> Cl2 | B.Cl2> Br2> I2 | C.Cl2> I2> Br2 | D.Br2> Cl2> I2 |
常温下,在下列溶液中发生如下反应:
①16H++10Z—-+2XO4—=2X2+ +5Z2+8H2O
②2A2++B2=2A3++2B-
③2B—+Z2=B2+2Z-
由此判断下列说法错误的是
| A.反应Z2+2A2+=2A3+ +2Z-可以进行 |
| B.Z元素在①③反应中均被还原 |
| C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| D.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强
| A.②⑤⑦ | B.①②⑦ | C.②④ | D.①③⑤ |
稀硝酸作为较强氧化剂在溶液中发生的反应是:NO3-+4H++3e-=NO↑+2H2O下列微粒能让此反应过程发生的是 ( )
①Fe2+ ②C ③S2- ④SO32- ⑤I- ⑥Al
| A.①③④⑤⑥ | B.①③④⑤ | C.②⑥ | D.全部 |
已知氧化性顺序是:Cl2﹥Br2﹥Fe3+﹥I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
| A.Fe3+ Br- Cl- | B.Fe2+ Br- Cl- |
| C.Fe2+ Cl- I- | D.Fe2+ Br- Cl- I- |
试题篮
()