从海带灰中可以提取碘,主要反应为:Cl2+2I- I2+2Cl-,下列说法不正确的是
I2+2Cl-,下列说法不正确的是
| A.该反应属于置换反应 | B.反应中I-离子发生还原反应 |
| C.Cl2的氧化性比I2的氧化性强 | D.生成1mol I2转移2mol e- |
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
⑴Cl2+2KI=2KCl+I2;
⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,
⑷H2S+I2=S+2HI;
| A.S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>S>I2 | D.Cl2>I2>Fe3+>S |
下列反应中,硝酸既表现酸性,又表现氧化性的是
| A.Fe2O3跟稀硝酸反应 |
| B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 |
| D.Al(OH)3跟稀硝酸反应 |
已知还原性强弱:I- > Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液加入溴水后,溴被还原,由此推断该溶液中
| A.不含NO3-,也不含Fe3+ | B.含有NO3-、I-、Cl- |
| C.含I-,不含Cl- | D.含有Fe3+ |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
| A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
下列变化需加入氧化剂才能实现的是( )
| A.Fe3+→Fe2+ | B.CuO→Cu | C.Cl- →Cl2 | D.H2SO4→BaSO4 |
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
已知在酸性溶液中的还原性强弱顺序为:SO2 > I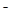 > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl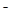 ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I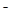 + Fe + Fe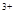 =I2 + Fe =I2 + Fe |
B.2Fe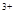 + SO2 + 2H2O=2Fe + SO2 + 2H2O=2Fe + SO + SO + 4H+ + 4H+ |
| C.SO2 + 2H2O + I2=H2SO4 + 2HI |
| D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O |
现有下列反应,据两式判断,还原性由强到弱的排列顺序正确的是
(1)2Fe3++2I— 2Fe2++I2 (2)Cl2+2Fe2+ 2Fe3++2Cl—
| A.Cl—>Fe2+>I— | B.I—>Fe2+> Cl— | C.Cl—>I—>Fe2+ | D.Fe2+>I—> Cl— |
在反应中3S+6KOH =2K2S+ K2SO3+3H2O,氧化剂与还原剂的质量之比是
| A.1∶2 | B.2∶1 | C.1∶1 | D.3∶2 |
试题篮
()