北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)一c(A-)= mol/L,c(OH-)一c(HA)= mol/L。
③已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”);
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2·2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 |
Fe3+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
6.7 |
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的_______(填代号)。
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是____________________________。
(2)检验溶液Ⅰ中的存在Fe3+实验操作是_____________________。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因________________;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为___________;
②达到滴定终点时,仰视滴定管读数将使测定结果__________(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为__________(用含m,c,V的代数式表示,不用化简)。
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是________________。
食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
| 弱酸 |
CH3COOH |
H2CO3 |
HNO2 |
| 电离常数 |
K=1.8×10-5 |
K=4.3×10-7 K=5.6×10-11 |
K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中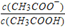 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
(1)25℃时,浓度为0.1 mol•L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_________________(填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh=__________ mol•L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=____,混合后溶液中离子的浓度由大到小的顺序为__________________。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=_________;m与n的大小关系是m___________n(填“>”“=”或“<”)。
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式正确的是
A.H2C2O4+CO32-= HCO3-+HC2O4- B.HC2O4-+CO32-= HCO3-+C2O42-
C.H2C2O4+CO32-= C2O42-+H2O+CO2 D.2C2O42-+CO2+H2O = 2HC2O4-+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)="2" c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
将0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:
(1)混合溶液中c(A-)________c(HA)(填“>”“<”或“=”,下同)。
(2)混合溶液中c(HA)+c(A-)________0.1 mol·L-1。
(3)混合溶液中,由水电离出的c(OH-)________0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
(4)25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
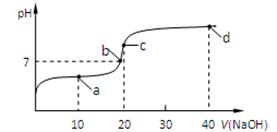
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择,并填空
A. M>N B. M<N C. M=N D. 无法比较
(1)相同温度下,1L 1 mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5 mol/L NH4Cl溶液中NH4+的个数: ;
(2)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(3)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
(4)用惰性电极分别电解NaCl溶液和CuSO4溶液,一段时间后,则两个电解池中前者阴极附近溶液的PH与后者阳极附近溶液的PH大小关系是: ;
(5)同条件下,一堆钢管单独露天堆放,另一堆钢管与铜管露天堆放在一起,则两堆钢管腐蚀的速率: ;
(6)PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
已知: I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O,加入CuO,调至pH=4,使溶 液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O。
(2)在空气中直接加热CuCl2·2H2O得不到纯的无水CuCl2,原因是 (用化学方程式表示)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I- 2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 可选用 作滴定指示剂,滴定终点的现象是 。
② 该试样中CuCl2·2H2O的质量分数为 。
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为__________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度____________(填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。丙认为,只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(3) 查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是___________________________。
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。

工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 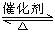 2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3)(填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) :c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。
常温下有下列四种溶液:
| |
① |
② |
③ |
④ |
| 溶液 |
pH=4的NH4Cl |
pH=4的盐酸 |
0.1 mol·L-1的醋酸 |
0.1 mol·L-1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10-5。请回答下列问题:
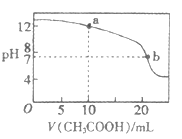
(1)用④的标准液滴定③宜选用 (填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 。
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是 (用序号表示),用pH试纸测定溶液pH的操作方法是 。
(3)都是0.1mol/L的①NH4Cl.②NH4HCO3.③CH3COONH4.④NH4HSO4的溶液中NH4+离子浓度大小顺序为 。(用序号填写)
(4)取适量溶液③滴定20 mL溶液④,滴定曲线如右图所示,则a点时溶液中各离子浓度的大小关系为 。若b点时消耗③的体积为V mL,则V 20(填“>”.“<”或“=”)。
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为:该溶液pH升高的原因是HCO的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_____________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
c.HCO3-的电离程度大于HCO3-的水解程度
试题篮
()