常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时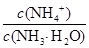 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| B.0.lmol/LNa2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.0.2mol/LNaA溶液和0.lmol/L盐酸溶液等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A—)+c(Cl—) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
(届山东省日照市高三3月模拟考试理综化学试卷)
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是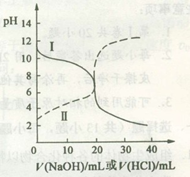
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 平衡 常数 |
Ka=1.8×10-5 |
 = =4.3×10-7 |
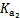 = =5.6×10-11 |
Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。 
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值), = 。
= 。
下列说法中正确的是
A.若M度T0C时水的离子积常数为KW在该温度下的中性溶液中c(H+)=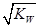 mol/L mol/L |
| B.25℃时HCl溶液中的c(H+)一定大于25℃时NH4Cl溶液中的c(H+) |
| C.1mol/LCH3COOH溶液和1mol • L-1KOH溶液等体积混合,混合溶液中c(K+)=c(CH3COO-) |
| D.pH =5.7的 NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
有关电解质溶液的叙述错误的是( )
A.向氨水中加水可使溶液中n(OH-)增大
B.若Na2A、Na2B溶液的pH分别为8和9,则酸性一定是H2A>H2B
C.常温下,pH=2的某二元强酸和pH=12的某一元强碱溶液等体积混合,所得溶液的pH一定等于7
D.0.5 mol/L的醋酸钠溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
下列说法正确的是
| A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+) + c(CH3COOH) =" 2" c(OH-) + c(CH3COO-) |
| D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为。
(2)25℃,在0.10-1
溶液中,通入
气体或加入
固体以调节溶液
,溶液
与
(
-)关系如图(忽略溶液体积的变化、
的挥发)。
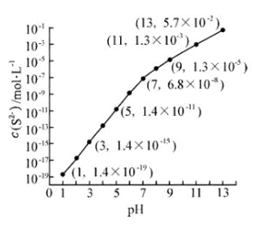
①pH=13时,溶液中的(
)+
(
-)=
-1.
②某溶液含0.020 -1
2+、0.10
-1
,当溶液
= 时,
2+开始沉淀。
[已知:(
)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式= 。
②0.10 -1
溶液中离子浓度由大到小的顺序为 。
③溶液和
溶液反应的主要离子方程式为。
下列叙述正确的是
| A.浓度均为0.1mol•L—1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: c(CH3COOH)+c(CH3COO—)=0.2mol•L-1 |
| B.0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2(CO32-) |
| C.0.2mol•L-1HCl溶液与等体积0.1mol•L-1NaOH溶液混合后,溶液的pH=1 |
| D.0.1mol•L-1氨水中滴入0.1mol•L-1盐酸至溶液呈中性时,混合溶液中:c(NH4+)=c(Cl—) |
SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
| A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-) |
| B.已知NaHSO3溶液pH<7,该溶液中:c(Na+)>c(HSO3-)>c(H2SO3) >c(SO32-) |
| C.当吸收液呈中性时:c(Na+)=2 c(SO32-)+c(HSO3-) |
| D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
| A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-) |
| D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
下列溶液中有关物质的量浓度关系正确的是
A.将0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合,则充分反应后的混合液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH相等的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液和NaOH溶液,其物质的量浓度由小到大的顺序为:c (NaOH)<c(CH3COONa)<c (NaHCO3)<c (C6H5ONa)
C.常温下,将pH=2.0的CH3COOH溶液和pH=12.0的NaOH溶液等体积混合,则充分反应后的混合液中:c (Na+)>c (CH3COO-)>c(OH-)>c (H+)
D.常温下,向10mL pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)、c(OH-)、c (CH3COOH)/c (CH3COO-)都将要变小
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表达不正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH ,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(HCO3- ) +c(H2CO3) +c(CO32-)=c(Na+) |
| C.相同温度下,l0mL 0.lmol·L-1的醋酸与100mL 0.01 mol·L-1的醋酸中H+的物质的量不相等 |
| D.相同温度下,中和体积与pH都相同的HCI溶液和CH3COOH溶液所消耗的NaOH的物质的量,后者多 |
试题篮
()