N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g) 4NO2 (g)+ O2(g) ΔH>0
4NO2 (g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
100 0 |
150 0 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s) + CO(g) MgO(s) + CO2(g)+SO2(g) △H>0
MgO(s) + CO2(g)+SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
压强 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
在恒温、恒容下,发生如下反应:2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;Ⅱ途径:C、D的起始浓度分别为2mol/L和6mol/L。以下叙述正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;Ⅱ途径:C、D的起始浓度分别为2mol/L和6mol/L。以下叙述正确的是
A.达平衡时,途径Ⅰ的反应速率V(A)等于途径Ⅱ的反应速率V(A)
B.达平衡时,途径Ⅰ所得混合气的浓度和途径Ⅱ所得混合气体的浓度相等
C.两途径最终达到平衡时,体系内混合气体的百分组成不同
D.两途径最终达到平衡时,体系内混合气体的百分组成相同
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列分析中不正确的是
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是

| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
下图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g) 反应过程中能量示意图。
CO2(g)+NO(g) 反应过程中能量示意图。
一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是
| A.该反应的焓变△H=234kJ/mol |
| B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 |
| C.若X表示反应时间,则Y表示的可能是混合气体的密度 |
| D.若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
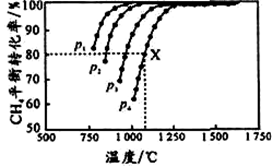
| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)⇌PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于0.40 mol |
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)  3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1 |
往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I-(aq) I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
| A.该反应的△H>0 |
| B.a、c两点对应的I-反应速率相等 |
| C.b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1 |
| D.d点时该反应在对应温度下处于平衡状态 |
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.d 点:v(正) > v(逆) |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
| A.2 mol SO2+ 1 mol O2 | B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 SO3 | D.3 mol SO2+ 1 SO3 |
工业上消除氮氧化物的污染可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+CO2(g)+2H2O(g) △H=a kJ·mol-1
在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如下表:
| 温度 |
n/mol |
时间/min |
||||
| 0 |
10 |
20 |
40 |
50 |
||
| T1 |
n( N2) |
0 |
0.20 |
0.35 |
0.40 |
0.40 |
| T2 |
n( N2) |
0 |
0.25 |
…… |
0.30 |
0.30 |
下列说法不正确的是
A.10min内,T1时的v(N2)比T2时的小
B.T1<T2
C.a<0
D.T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol
将一定质量的固体NH4I置于密闭容器中,在某温度下发生下列反应:
①NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
②2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
5min后达平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则下列说法不正确的是
| A.用NH3表示反应①的速率为1 mol/(L·min) |
| B.体系中颜色不再变化时,可判断反应均已达平衡 |
| C.该温度下反应①的平衡常数为20 mol2/L2 |
| D.加压时反应②的平衡不会移动 |
有三个容积相同的容器①②③均发生如下反应:3A(g)+ B(g)  2C(g);△H<0,①容器容积固定,外有隔热套;②容器容积固定;③容器有活塞可移动。下列说法正确的是 ( )
2C(g);△H<0,①容器容积固定,外有隔热套;②容器容积固定;③容器有活塞可移动。下列说法正确的是 ( )
A.若维持温度不变,起始时②中投人3mol A、l mol B;③中投入3 mol A、l mol B和2 mol C,则达到平衡时,两容器中B的转化率②=③。
B.若起始温度相同,分别向三个容器中充入3 mol A和1mol B,则达到平衡时各容器中C 物质的百分含量由大到小的顺序为③>②>①。
C.若起始温度相同,分别向三个容器中充入1 mol A和1molB则达到平衡时各容器中C 物质的百分含量一定相同。
D.若起始温度相同,分别向三个容器中充入3a mol A 和a molB 则达到平衡时各容器中A 物质的转化率一定相同。
试题篮
()