用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是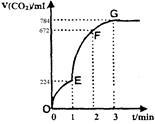
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.6mol/(L·min) |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 |
| D.G点表示收集的CO2的量最多 |
反应4NH3+5O2 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
| A.v(O2)=0.0125 mol·(L·s)-1 |
| B.v(NO)=0.01mol·(L·s)-1 |
| C.v(H2O)=0.12 mol·(L·s)-1 |
| D.v(NH3)=0.1 mol·(L·s)-1 |
甲、乙两容器中都在进行A B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
| A.甲快 | B.乙快 | C.相等 | D.无法确定 |
反应2SO2+O2 2SO3经a min后,SO3浓度的变化情况如图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于
2SO3经a min后,SO3浓度的变化情况如图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于
| A.0.1 | B.2.5 | C.5 | D.10 |
对于可逆反应A(g)+3B(s) 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
在一定条件下发生反应2A(g)===2B(g)+C(g),将2 mol A通入2 L容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A的物质的量为0.8 mol。用B的浓度变化来表示该反应的速率为
| A.0.24 mol/(L·min) | B.0.08 mol/(L·min) |
| C.0.06 mol/(L·min) | D.0.12 mol/(L·min) |
对于可逆反应A(g)+3B(g)⇌2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.V(A)="0.5" mol/(L・min)
B.V(B)="1.2" mol/(L・min)
C.V(C)="0.4" mol/(L・min)
D.V(C)="1.1" mol/(L・min)
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0. 6 mol·L-1·s-1;③2 s时物质A的转化率为70%;④2 s时物质B的浓度为0.7 mol·L-1,其中正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0. 6 mol·L-1·s-1;③2 s时物质A的转化率为70%;④2 s时物质B的浓度为0.7 mol·L-1,其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
| A.用A表示的反应速率是0.4 mol/(L·min) |
| B.用B表示的反应速率是0.3 mol/(L·min) |
| C.2 min末时的反应速率,用B表示是0.3 mol/(L·min) |
| D.在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大 |
将4 mol A气体和2 mol B气体在 2 L容器中混合并在一定条件下发生如下反应:2A(g)+B(g)=" 2C" (g)若经2 s后测得C的浓度为0.6 mol•L-1,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol•L-1•S-1
②用物质B表示的反应的平均速率为0.6 mol•L-1•S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol•L-1
| A.①③ | B.①④ | C.②③ | D.③④ |
铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
| A.0.02 mol/(L・min) | B.1.8mol/(L・min) |
| C.1.2 mol/(L・min) | D.0.18 mol/(L・min) |
在密闭容器中A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)表示。已知υ(A)、υ(B)、υ(C)之间有以下关系2υ(B)==3υ(A),3υ(C)==2υ(B)。则此反应可表示为
A.2A+3B==2C B.A+3B="=" 2C
C.3A+B==2C D.A+B==C
在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
| A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1 |
| B.在2 s时,体系内压强为反应前的1.1倍 |
| C.平衡时,体系内含N2O4 0.25 mol |
| D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率 |
试题篮
()