700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)= mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时n(CO2)=0.30 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
在密闭容器中进行的可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(mol·L-1·s-1)表示,且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),3v(C)=2v(B),则此反应可表示为
A.2A+3B 2C B.A+3B
2C B.A+3B 2C
2C
C.3A+B 2C D.A+B
2C D.A+B C
C
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )

| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.当NaHSO3消耗时的离子方程式为:5HSO3-+2IO3-=5SO42-+I2+3H++H2O |
| C.图中a点对应的NaHSO3反应速率为5.5×10-5 mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该实验的指示剂 |
下列说法正确的是
| A.有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而使反应速率增大 |
| B.增大反应物浓度,可增大活化分子的百分数,从而使单位时间内有效碰撞次数增多 |
| C.在化学反应中,加入催化剂只能增大正反应速率 |
| D.升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 |
在2A+B  3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A)= 0.5mol·L-1·s-1 B.υ(B)= 0.3 mol·L-1·s-1
C.υ(C)= 0.8mol·L-1·s-1 D.υ(D)=" 1" mol·L-1·s-1
在不同条件下,分别测得反应2SO2+O2 2SO3的速率如下,其中最快的是
2SO3的速率如下,其中最快的是
| A.v(SO2)=4 mol/(L·min) | B.v(O2)=2 mol/(L·min) |
| C.v(SO2)=0.1 mol/(L·min) | D.v(SO2)=0.1 mol/(L·s) |
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是
| A.化学反应速率理论可指导怎样提高原料的转化率 |
| B.化学反应速率理论可指导怎样在一定时间内快出产品 |
| C.化学平衡理论可指导怎样使用有限原料多出产品 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
20℃时,将0.1 mol·L-1 Na2S2O3溶液10 mL和0.01 mol·L-1 H2SO4溶液10 mL混合,2 min后溶液中明显出现浑浊,已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要看到同样的浑浊,需要的时间是
| A.40 s | B.15 s | C.48 s | D.20 s |
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为( )。
A.2A+3B=2C B.A+3B2=C C.3A+B=2C D.A+B=C
对于反应4CO(g)+2NO2(g)  N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
| A.v(CO)=1.6 mol·(L·min) -1 | B.v(NO2)=0.9 mol·(L·min) -1 |
| C.v(N2)=0.25mol·(L·min) -1 | D.v(CO2)=1.2 mol·(L·min) -1 |
一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是
A.该反应的化学方程式为3B+4C 6A+2D
6A+2D
B.反应进行到1 s时,v(A)和v(D)不相等
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的浓度不再变化,反应速率为零
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)=" 0.40" mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是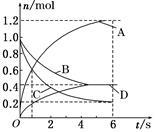
A.该反应的化学方程式为3B+4D 6A+2C 6A+2C |
B.反应进行到1 s时,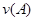 = =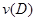 |
| C.反应进行到6s时,B的平均反应速率为0.05 mol/(L·s) |
| D.反应进行到6s时,各物质的反应速率相等 |
已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A. v(NH3)=v(O2) v(NH3)=v(O2) |
B. v(O2)=v(H2O) v(O2)=v(H2O) |
C. v(NH3)=v(H2O) v(NH3)=v(H2O) |
D. v(O2)=v(NO) v(O2)=v(NO) |
对于A2+3B2 = 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是
A. (A2)=0.4 mol·L-1·s-1 B.
(A2)=0.4 mol·L-1·s-1 B. (B2)=0.8 mol·L-1·s-1
(B2)=0.8 mol·L-1·s-1
C. (C)=0.6 mol·L-1·s-1 D.
(C)=0.6 mol·L-1·s-1 D. (D)=0.6 mol·L-1·min-1
(D)=0.6 mol·L-1·min-1
试题篮
()