可逆反应A(g)+3B(g) 2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率最大的是
2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.3 mol/(L·min)
C.v (C)=0.2 mol/(L·min) D.v (D)=0.1 mol/(L·min)
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
在一个2L的密闭容器中,某一反应物的物质的量为1.0 mol,经过20s后,它的物质的量变成了0.6 mol,在这20 s内它的反应速率为
| A.0.4mol/L | B.0.02mol/(L·s) |
| C.0.01mol/L | D.0.01mol/(L·s) |
在密闭容器中进行X2(g)+4Y2(g)  2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1 mol·L-1、0.4 mol·L-1、0.4 mol·L-1、0.3 mol·L-1,当反应到某时刻时,各物质的浓度不可能是
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1 mol·L-1、0.4 mol·L-1、0.4 mol·L-1、0.3 mol·L-1,当反应到某时刻时,各物质的浓度不可能是
| A.c(X2)=0.15 mol·L-1 | B.c(Y2)=0.7 mol·L-1 |
| C.c(Y2)=0.3 mol·L-1 | D.c(Q2)=0.6 mol·L-1 |
在N2+3H2 2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4mol/L,则以氢气的浓度变化表示该反应在2s内的平均反应速率是
2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4mol/L,则以氢气的浓度变化表示该反应在2s内的平均反应速率是
| A.0.3mol/(L·s) | B.0.4 mol/(L·s) |
| C.0.6 mol/(L·s) | D.0.8 mol/(L·s) |
反应2SO2(g)+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
| A.0.1 s | B.2.5s | C.10s | D.5s |
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示2min内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大
反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率V(x)(表示反应物的消耗速率或生成物的生成速率)
| A.平均速率V(O2)=0.01mol/(L·s) |
| B.平均速率V(NO)=0.008mol/(L·s) |
| C.平均速率V(H2O)=0.002mol/(L·s) |
| D.平均速率V(NH3)=0.002mol/(L·s) |
在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体)。请回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2分钟时,用C表示反应速率为 mol/(L•min),平衡时A的转化率为 。
(3)其它条件不变,当第3min条件发生以下变化时,能加快化学反应速率的是____。
①加入(正)催化剂 ②充入一定量He
③充入一定量的A ④降低温度
在2A+B  3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A)= 0.5mol·L-1·s-1 B.υ(B)= 0.3 mol·L-1·s-1
C.υ(C)= 0.8mol·L-1·s-1 D.υ(D)=" 1" mol·L-1·s-1
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+ 3Y2(g) 2XY3(g)△H=-92.6 kJ.mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g)△H=-92.6 kJ.mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达到平 衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)="1/30" mol·L-1·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速度最快的是
2C的反应来说,以下化学反应速率的表示中,反应速度最快的是
A.v(B2)="0.8" mol/(L·s) B.v(B2)= 3mol/(L·min)
C.v(C)="0.6" mol/(L·s) D.v(A2)="0.4" mol/(L·s)
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是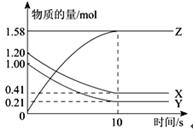
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0 % |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
在一个0.5L密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下发生反应N2(g) + 3H2(g)  2NH3(g)。10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
2NH3(g)。10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
| A.0.1mol·L-1·min-1 | B.0.6mol·L-1·min-1 |
| C.0.3mol·L-1·min-1 | D.0.2mol·L-1·min-1 |
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.40" mol·L-1·s-1
B.υ(C)="0.50" mol·L-1·s-1
C.υ(A)="0.30" mol·L-1·s-1
D.υ(B)="0.60" mol·L-1·s-1
试题篮
()