在2L密闭容器内,800℃时反应:2NO(g)+O2(g)≒2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知:K(300℃)>K(350℃),该反应是_ 。
(2)如图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变[
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒 气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 |
B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
(2)该反应达到平衡时若增大压强,则混合气体的 平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).t1:增大NO的浓度 t2:降低温度
(4)判断该条件下反应能否自发.
在某一化学反应中,反应物B的物质的量浓度在5 s内从2.0 mol·L-1变成
0.5 mol·L-1,在这5 s内B的化学反应速率为 。
(改编题) CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A v正(CH3OH)=v正(CO2)
B 混合气体的密度不变
C 混合气体的平均相对分子质量不变
D CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向 移动的是 (填序号)。
移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
(共16分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N2 3 mol H2经过10s达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,b mol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)容器甲10 s 内用H2表示的平均反应速率v(H2) = _____,达平衡时N2的转化率= ____。
(2)下列哪些情况表明容器乙已达平衡状态?( )
| A.容器乙的气体密度不再变化 | B.氢元素的质量不再变化 |
| C.氮气的生成速率等于氨气的消耗速率 | D.断裂1 mol N≡N键同时断裂6 mol N—H键 |
(3)达平衡时甲容器的压强 乙容器的压强(填“等于”、“大于”或“小于”)。
(4) a = _______________mol,b = ______________mol。
(5) 达平衡时乙容器的体积为_____________L。
(6)起始时容器乙是容器甲压强的_______________倍。
(8分)(2011·泰州模拟)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 |
时间 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820 |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0 mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。
为了减少温室气体排放,目前工业上采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)  CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO2)(mol) |
0.40 |
0.35 |
0.31 |
0.3 |
0.3 |
0.3 |
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是 ,
(2)平衡时CO2的转化率是 。
(3)能说明反应已达平衡状态的是 。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。(填序号)
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂
(10分)下列各项反应速度的差异,分别与哪个因素的关系最密切?
(1)硫在O2中比在空气中燃烧剧烈: ;
(2)卤化银要保存在棕色试剂瓶中 ;
(3)MnO2加入双氧化水中反应更剧烈 ;
(4)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完 ;
(5)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生 。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为 ,反应开始前容器中A、B的物质的量为 ;
(2) B的平均反应速率为 ;
(3)x= 。
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小颗粒______________________;
(2)夏天的食品变霉,在冬天不易发生该现象
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢_____;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同______________________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体________________。
(共10分)某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求: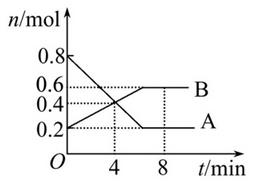
(1)该反应的化学方程式为 。
(2)反应开始 至4 min时,A的平均反应速率为 。(要求写出计算过程)
至4 min时,A的平均反应速率为 。(要求写出计算过程)
(3)第4min末时A、B的物质的量浓度依次为________、________。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
要增大 Zn 和稀 H2SO4间置换反应的速率,下列措施正确的是
| A.使用高纯度的锌粒 | B.使用浓H2SO4 |
| C.使用小颗粒的锌粒 | D.使用浓HNO3 |
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W (g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol/(L·min),
(1)则这2 min内v(X) = v(W) =
(2)2 min末时Y的浓度
(3)化学反应方程式中n的值是
(4)2min末时,已用去的X占原 来总物质的量分数为
来总物质的量分数为
(10分)某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示) ,请你帮助该小组同学回答下列问题:
(1)曲线OA段不产生氢气的原因是_____________ _ ______
____________________ _____,
有关的离子反应方程式为_________________________ _____ _____
(2)曲线BC段产生氢气的速率突然加快的主要原因是
____________________________________________________________________________
(3)点C以后产生氢气的速率逐渐减小的主要原因是
____________________________________________________________________________
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)___________
将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)  2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
“不变”填空)。
| 编号 |
改变的条件 |
生成D的速率 |
| ① |
降低温度 |
|
| ② |
增大A的浓度 |
|
| ③ |
使用催化剂 |
|
| ④ |
恒容下冲入Ne(不参与体系反应) |
|
试题篮
()