一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如下图所示。下列判断判断正确的是
| A.在0−50min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20−25min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
可逆反应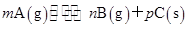
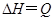 ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )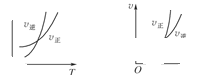
| A.m>n,Q>0 | B.m>n+p,Q>0 |
| C.m>n,Q<0 | D.m<n+p,Q<0 |
下列叙述正确的是
| A.硅是一种重要的非金属单质,可用于制造太阳能电池 |
| B.硫在足量的空气中燃烧生成SO3 |
| C.钠在空气中燃烧生成氧化钠 |
| D.与同浓度稀盐酸反应的速率:Na2CO3>NaHCO3 |
下列说法不符合生产实际的是( )
| A.硫酸生产中,SO2催化氧化选择1~10 MPa、400~500 ℃条件下进行 |
| B.尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理 |
| C.工业上,常采用以铁为主的催化剂,在400~500 ℃和10~30 MPa的条件下合成氨 |
| D.造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2 |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.移去部分SO3 | B.增大容器的体积 |
| C.通入大量O2 | D.升高体系温度 |
在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是
①缩小容器的体积 ②增加碳的量 ③通入CO2
④恒压下充入N2 ⑤恒容下充入N2 ⑥通入CO
| A.①③⑤ | B.②④⑥ | C.①③⑥ | D.③⑤⑥ |
燃烧硫铁矿产生SO2 ,为了提高生成SO2的速率,下列措施可行的是( )
| A.把块状矿石碾成粉末 | B.降低O2的浓度 |
| C.使用负催化剂 | D.降低温度 |
下列措施中,能减慢化学反应速率的是
| A.食物储存在冰箱里 |
| B.用30% H2SO4溶液代替5% H2SO4溶液与锌粒反应 |
| C.将块状固体药品研细后再反应 |
| D.用MnO2作H2O2分解反应的催化剂 |
在一密闭容器中,加入物质A和B后发生反应aA(S)+bB(g) cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是( )
cC(g),此反应是放热反应。关于化学反应速率的叙述正确的是( )
| A.升高温度时,正反应速率加快,逆反应速率减慢 |
| B.增加少量的A物质,正反应的化学反应速率加快 |
| C.增大压强,正反应速率加快,逆反应速率也加快 |
| D.达到平衡时消耗B的物质的量一定等于消耗C的物质的量 |
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为( )
| A.0.1s | B.2.5s | C.5s | D.10s |
对于反应2SO2 + O2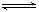 2SO3,下列变化可增大活化分子百分数而使反应速率加快的是( )
2SO3,下列变化可增大活化分子百分数而使反应速率加快的是( )
试题篮
()