下列每组对比实验不能达到实验目的是
| 选项 |
实验设计 |
实验目的 |
|
| 实验一 |
实验二 |
||
| A |
将带火星的木条伸入装有5
5%的过氧化氢溶液的试管中 |
将带火星的木条伸入装有少量
和5
5%的过氧化氢溶液的试管中 |
探究催化剂对化学反应速率的影响 |
| B |
将铁丝放入2
10%的硫酸铜溶液中 |
将银丝放入2
10%的硫酸铜溶液中 |
探究铁、铜、银三种金属的活动性顺序 |
| C |
将5
氯化钠加入20
20℃的水中 |
将5
硝酸钾加入20
10℃的水中 |
比较两种物质溶解度大小 |
| D |
将植物嫩叶浸泡在10
蒸馏水中 |
取10
蒸馏水,通入过量二氧化硫气体,再将植物嫩叶浸泡其中 |
模拟酸雨的危害 |
通过下列实验可以得出的结论,其中不合理的是( )
| A.甲实验中黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大 |
| B.乙实验既可以说明分子在不停地运动着,又可以说明氨水显碱性 |
| C.丙实验既可以将粗盐提纯,又可以说明氯化钠的溶解度随温度的升高而增大 |
| D.丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
碳酸氢钠(NaHCO3)是发酵粉的主要成分,常用于制作糕点、馒头的发泡剂。某同学为探究发酵粉样品中NaHCO3的质量分数,他取样品20.0g,进行如图实验探究:

假设样品中除NaHCO3之外的其他成分加热不发生变化,也不与盐酸反应,直接进入固体B中。下列判断正确的是( )
A.加热产生CO2的质量为3.1g
B.固体A中含有Na2CO3的质量为7.5g
C.蒸发结晶得到的固体B中含有剩余的HCl
D.原发酵粉样品中的NaHCO3的质量分数为84.0%
过氧化氢( )是一种无色液体,常用作氧化剂、漂白剂和消毒剂。为了贮存、运输和使用的方便,工业上将过氧化氢转化为固态的过碳酸钠晶体( ),该晶体具有碳酸钠和过氧化氢的双重性质。下列物质不会使过碳酸钠失效的是
| A. | 二氧化锰 | B. | 澄清石灰水 | C. | 盐酸 | D. | 氯化钠 |
右图是测定空气中氧气体积分数的实验,实验后发现测定氧气的含量低于1/5.针对这一事实,你认为下列做法和想法不可取的是 ( )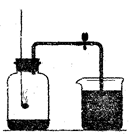
| A.查看实验装置是否漏气 |
| B.将红磷改成木炭后重新实验 |
| C.实验中红磷的量不足,没有将瓶内的氧气全部消耗尽 |
| D.实验中可能未冷却到室温就打开止水夹,使进入瓶内的水的体积不足 |
下列有关实验现象的描述正确的是 ()
| A. | 红磷在氧气中燃烧产生大量的白烟 |
| B. | 向稀盐酸中滴加适量紫色的石蕊试液,溶液的颜色由无色变成蓝色 |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰 |
| D. | 打开盛有浓硫酸的试剂瓶瓶盖,瓶口上方出现大量白雾 |
下列对有关实验异常现象分析合理的是 ()
| A. | 铁丝在氧气中燃烧时集气瓶瓶底炸裂--铁丝没有制成螺旋状 |
| B. | 向澄清石灰水中通入二氧化碳无明显现象--可能是石灰水变质 |
| C. | 将表面未处理的铝丝插入硫酸铜溶液中无明显现象--铝的金属活动性比铜弱 |
| D. | 在粗盐提纯实验中过滤速率过慢--没用玻璃棒引流 |
右图是同学们利用大可乐瓶设计的储气装置(铁架台未画出),以下说法不正确的是 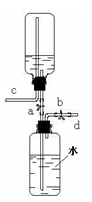
| A.打开止水夹a、b,气体从d管导入储存在下面的瓶子里,水被压入上瓶 |
| B.取用气体时,可通过控制止水夹a 、b,靠水的重力方便地将气体排出 |
| C.气体被储存在装置中后,c导管也必须安装止水夹 |
| D.该装置也可作为实验室制取二氧化碳的发生装置 |
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;
②CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe;
③NaOH溶液与石灰水相似,能吸收CO2,但不变浑。
④
| 物质性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
| 颜色 |
黑色 |
黑色 |
红色 |
黑色 |
| 能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
(2)进行猜想:黑色固体粉末可能a.全部为铁、 b. 、c. 。
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称) 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
(6)上述反应产生CO2的质量为 g;
(7)计算该赤铁矿石中氧化铁的质量分数。 。(需要有计算过程)
小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。
【提出问题】 该淡黄色固体的化学成分是什么?
【查阅资料】
(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
【设计实验方案】
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,你认为的最佳方案是 ,理由是(从环保或操作角度分析) 。
【实验验证并得出结论】
小明向盛有少量该固体的试管中加入2mL水,立刻观察到有无色气泡产生,并且验证出该反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
小明想对生成的气体成分判断,他提出了以下两种假设:①该气体是CO ②该气体是O2
你认为上述假设哪个更合理 (填“①”或“②”)。
请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
| 操作步骤 |
实验现象 |
结论 |
| |
|
|
【分析】过氧化钠与水反应的文字表达式为 。
【计算】在过氧化钠(Na2O2)中,
①氧元素的化合价为 ;
②过氧化钠的相对分子质量为 ;
③ 过氧化钠中钠、氧元素的质量比为 ;
④78克过氧化钠与多少克二氧化碳中所含氧元素的质量相等?(列式计算)
为确定某溶液中含有以下离子H+、Mg2+、Ba2+、Cl﹣、CO32﹣、NO3﹣中的几种,进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液,加入过量NaOH溶液,有白色沉淀产生;
③取②中部分溶液,加入Na2CO3溶液,无明显现象。
分析上述实验,下面对溶液中含有离子的判断,正确的是( )
A.一定含有H+、Mg2+、Ba2+、Cl﹣、NO3﹣
B.一定含有H+、Mg2+、Cl﹣,一定不含有CO32﹣
C.一定含有H+、Ba2+、NO3﹣,一定不含有Cl﹣
D.一定含有H+、Mg2+,可能同时含有Cl﹣、NO3﹣
某同学按如下步骤对三种未知金属展开探究:
(1)将它们编号为:X、Y、Z;
(2)取样,分别加入到CuSO4溶液中,发现X、Z表面出现红色物质而Y却没有;
(3)取X、Z大小相等的颗粒,分别加入到溶质质量分数相等的稀H2SO4中,发现X表面产生气泡的速度明显比Z快,则X、Y、Z的金属活动性由强到弱依次为
| A.X>Y>Z | B.Z>Y>X | C.X>Z>Y | D.Z>X>Y |
二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(Ⅰ)和(Ⅲ)中的小花变红,(Ⅱ)中的小花不变色。
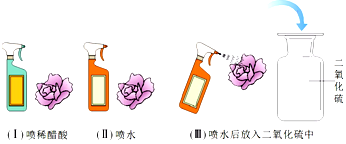
【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验还不足以证明"二氧化硫和水反应生成了酸"。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
| 实验操作 |
实验现象 |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式:。
下列图像不能正确反映其对应变化关系的是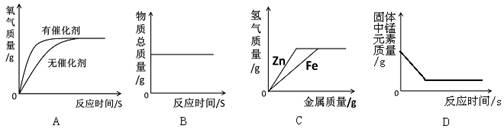
| A.用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气 |
| B.一定质量的红磷在密闭容器中燃烧 |
| C.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 |
| D.加热一定量高锰酸钾制氧气 |
试题篮
()