水和溶液与人类生存和发展密切相关。
(1)从海水中获取氯化钠的方法是_________。
(2)海水淡化可缓解水资源日益短缺的状况。下列有关海水淡化的方法可行的是 。
A. 用过滤的方法使海水淡化
B. 用降温的方法将海水变成淡水
C. 利用太阳能将海水蒸发再冷凝收集淡水
(3)NaCl和KNO3的溶解度曲线如图所示:
① 将100 g40℃时的NaCl和KNO3的饱和溶液分别降温至20℃,所得溶液的质量关系是NaCl ______ KNO3(“>”、“="”" 或“<”)
② 20℃时向两个分别盛有45 g NaCl和KNO3的烧杯中加水,完全溶解形成饱和溶液时,盛有_____的烧杯中需要加入更多量的水。
③ 将800 g溶质的质量分数为20%的NaCl溶液稀释为16%的NaCl溶液,用于农业选种,需要加入水的质量为________ g。
(6分) 水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)下图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为 mL,发生反应的化学方程式为________。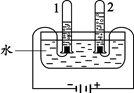
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300 g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
(4)根据下表回答问题。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度 /g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
| NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
65.6 |
77.3 |
① 60 ℃时,向两个分别盛有50 g NaCl和NH4Cl的烧杯中,各加入100 g的水,充分溶解后,为饱和溶液的是________溶液。
② 将上述实验后的两个烧杯均降温至40℃。下列说法中,正确的是________(填字母序号)。
A.两个烧杯中的溶液均为饱和溶液
B.两个烧杯中溶液的质量都可能不变
C.两个烧杯中溶液的质量减小的一样多
D.两个烧杯中溶质的质量分数都一定减小
(1)下图是甲、乙两种固体物质的溶解度曲线图。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。请根据图(一)回答问题: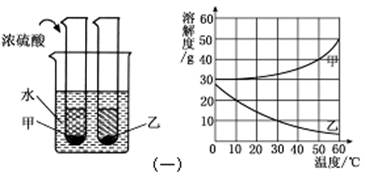
a.50℃时,甲物质的溶解度是 g;
b.30℃时,甲、乙两种物质的溶解度大小顺序是 ;
c.烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是 ;
除了加浓硫酸外,还可以加 物质,也会发生这样的变化。
(2)40℃时将图(二)甲、乙、丙物质的饱和溶液各100g降温至0℃,
所得溶液的质量分数的关系是: 。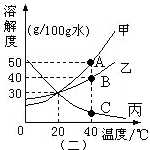
下图是甲、乙两种固体物质的溶解度曲线,回答下列相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,t1℃时,200g水中溶解 g乙,溶液达到饱和。
(2)t2℃时,比较甲、乙两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (只写一种)
(4)若将t10C 时的甲物质的饱和溶液200克和乙物质的饱和溶液400克分别升温到t2 0C(不考虑水分蒸发)两物质的溶液中溶质的质量分数的关系是:甲 乙(填大于、小于或等于)。
溶液的应用非常广泛,K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
| 温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
| 溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
| KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |

(1)图1中能表示KNO3溶解曲线的是 (填“甲”或“乙”)
(2)曲线上M点的含义是 。
(3)30℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至30℃,其结果如图2所示。下列有关说法中,正确的有 。
A.烧杯①中溶解的是KNO3,烧杯②中溶解的是K2CO3
B.烧杯②中溶液是不饱和溶液
C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
D.将得到的烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能不变
如图(甲)是A、B、C三种固体物质的溶解度曲线图。回答下列问题:
(1)曲线上的P点表示的意义为______________________________;
(2)t2℃时,在50g水中加入20gA物质充分溶解,所得溶液中物质与溶液的质量比为________________。
(3)如下图(乙)所示,往常温下的蒸馏水中慢慢加入浓硫酸,结果发现试管内的溶液中出现晶体。则X应该是A、B、C三种物质中的______________。
(4)t1℃时,将A、B、C三物质的饱和溶液分别升温到t2℃,所得溶液的溶质质量分数的由大到小的关系是_________________。
如图是甲、乙两种固体物质的溶解度曲线.
(1)由图中可看出,甲乙两物质中,溶解度受温度影响较大的物质是 ;
(2)要使甲的饱和溶液变为不饱和溶液,可采取的方法是 (写出一种即可);
(3)t2℃时,将甲、乙各20g分别加入到两只盛有100g水的烧杯中,充分搅拌,所得乙溶液为 溶液(填“饱和”或“不饱和”);若将温度都降低到t1℃,甲溶液中溶质的质量分数 (填“>”、“<”或“=”)乙溶液中溶质的质量分数.
(如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)乙物质的溶解情况是 _________ ;
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: _________ ;(用a、b、c填写)
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是 _________ ;(用甲、乙、丙填空)
(4)40℃时,溶液中含水最少的是 _________ 物质.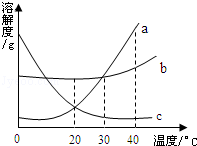
(根据溶液的知识回答下列问题.
(1)20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四个各盛有50g水的烧杯中,充分溶解,其溶解情况如表.根据表中数据回答下列问题:
| 物质 |
甲 |
乙 |
丙 |
丁 |
| 未溶解固体的质量/g |
4.2 |
2 |
0 |
9.2 |
①所得四杯溶液 _________ 不一定是饱和溶液(填序号,下同)
②所得四杯溶液中 _________ 的溶质质量分数最小.
(2)如图是A、B、C三种物质的溶解度曲线,据图回答:
①t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,将其变为不饱和溶液的方法是 _________ ;
②t3℃时,将等质量A、B、C的饱和溶液降温至t2℃时,所得A、B、C的三种溶液中溶质质量分数由小到大的顺序是 _________ .
(4 分)(1)溶解度可表示物质溶解性的大小。下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。试回答下列问题:
① t 1℃,甲物质饱和溶液溶质质量分数 乙物质饱和溶液溶质质量分数(填“<”“=”“>”之一);
② t 1℃时,将30g乙物质放入50g水中,充分溶解后,得到溶液的质量为______________;
③ t2℃时,取甲、乙两种物质的饱和溶液,降温到t 1℃,有晶体析出的为 ,原因是_________________________________________ 。
根据图一实验现象和图二的甲、乙溶解度曲线回答下列问题:
①水具有 性,可以作为溶剂使用。
②图二中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是 。(填写编号)
③t2℃时,50克水中加入 克甲物质,所得溶液恰好饱和。
④90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是 g。
⑤在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图一所示,则两溶液质量分数甲 (填“大于”或“小于”)乙,实验时控制的温度范围是 时,均能达到上述现象。
根据下面的溶解度表与溶解度曲线,回答下列问题:
| 温度/°C 溶解度/g |
0 |
20 |
40 |
60 |
80 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
| NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
(1)氯化钠溶液中的溶剂是 。
(2)20℃时,NaCl的溶解度是 g。
(3)图中能表示KNO3溶解度曲线的是 (填“A”或“B”)。
(4)20℃时,将40g KNO3放入盛有100g水的烧杯中,充分溶解,得到硝酸钾溶液的质量为 g,继续加热至80℃,下列各量一定变大的是 (填字母序号)。
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数
(5)实验室配制500g 10%氯化钠溶液需要氯化钠固体质量 g。
下图是几种固体的溶解度曲线。
(1)10℃时,这几种固体中 的溶解度最小。
(2)向烧杯中加入100g水,将含160g硝酸钾和10g
氯化钠的混合物加入该烧杯中,溶解配成80℃
的溶液,再冷却到10℃,烧杯中析出的固体的
名称是 ,质量是 g。当硝酸钾中含
有少量氯化钠时,可采用 (填“降温”或
“蒸发”)结晶的方法提纯硝酸钾。
(3)在40℃时,将溶质质量分数相等的KNO3和NaCl溶液,冷却到20℃,此时关于它们溶质质量分数的下列说法错误的是 (选填编号)
A.可能KNO3溶液的溶质质量分数大
B.可能NaCl溶液的溶质质量分数大
C.两者可能仍旧相等
(4)下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
用上图表示的序号表示配制溶液的正确操作顺序 ,上图所示的配制过程还有两种仪器未画出,它们是 。将100g氯化钠溶液的溶质质量分数由10%增大为20%,若保持溶剂质量不变,需加氯化钠固体的质量是 g。
(6分) 如图是a、b、c三种固体物质的溶解度曲线
(1)在t1℃时,a、b、c三种物质中,溶解度最大的是_____
(2)t1℃时,将30g a物质放入100g水中,充分搅拌, 所形成的溶液是 溶液(填“饱和”或“不饱和”);溶液中溶质质量分数是_______(精确到0.1%); 此时若将温度由t1℃升至t2℃,还应再加入a物质 g,才能变成饱和溶液。
(3)从a、c的饱和溶液中提取a,应采用方法是 (填“冷却结晶”或“蒸发溶剂”)。
如图为NaCl、KNO3的溶解度曲线,回答下列问题: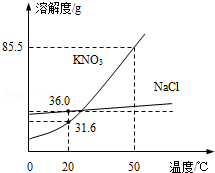
(1)20℃时,KNO3的溶解度是 g。
(2)某实验小组进行以下实验:
10 g水 X
X Y
Y  Z
Z
X、Y、Z中为饱和溶液的是 。
(3)把NaCl的不饱和溶液变为饱和溶液,下列方法中一定可行的是 (填序号)
A.降低温度 B.加入NaCl固体 C.蒸发溶剂
(4)提纯KNO3中混有少量的NaCl 可采用 方法
试题篮
()