将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。


(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |
(5)实验中所用NaOH溶液的溶质质量分数为 。
归纳总结是化学学习的常用方法,下图是对生成物质A的反应关系的归纳与整理。
请回答下列问题:
(1)写出A的化学式: ,反应③
的基本厦应类型是 。
(2)写出反应⑤的化学方程式:
。
该反应在医疗上的用途是: 。
(3)反应⑥能够进行的原因是 。
(4)请根据上图的反应关系,总结出盐酸化学性质。(任写2点)
、 。
将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题: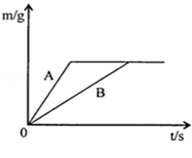
(1)写出锌与稀硫酸反应的化学方程式 。
(2)对于该图象的理解,下列说法正确的是 (填序号)。
①A表示锌和稀硫酸的反应曲线
②反应结束后两种金属一定都有剩余
③反应结束后稀硫酸都没有剩余
④反应结束后消耗两种金属的质量相等
⑤反应结束后所得溶液质量相等
如图是a、b两种固体物质的溶解度曲线,试回答:
(1)t℃时,两种固体物质的溶解度大小关系为a b(填“>”“<”“=”);
(2)当a中含有少量b时,可以用 法提纯a.
不同温度下,碳酸钠和碳酸氢钠的溶解度如下表所示
| 温度/℃ 溶解度 |
0 |
20 |
40 |
60 |
| 碳酸钠 |
7.0 |
21.8 |
48.8 |
46.4 |
| 碳酸氢钠 |
6.9 |
9.6 |
12.7 |
16.4 |
(碳酸钠、碳酸氢钠)俗称小苏打(请在选择的物质下面划线)。
(2)服用碳酸氢钠治疗胃酸过多时,胃液的pH (填“增大”、“减小”或“不变”),发生反应的化学方程式是 。
(3)为区分碳酸钠和碳酸氢钠两种白色固体。在20℃时,各盛有50 mL水的甲、乙两烧杯中,分别加入等质量的碳酸钠和碳酸氢钠固体,充分溶解后,现象如图所示。乙烧杯中加入的物质是 (填化学式),加入的质量m的范围为: 。
某化学兴趣小组在老师指导下制取、干燥、收集氨气,并探究氨气的一些性质。
资料卡片:氨气通常情况下是有刺激性气味的无色气体,密度比空气小,极易溶于水,易液化,液氨可作制冷剂。
加热熟石灰和氯化铵固体混合物的方法可以生成氨气。如要快速产生氨气,可以将浓氨水滴加到生石灰中得到。
(1)利用A装置制取氨气的化学方程式为 。将浓氨水滴加到生石灰快速产生氨气,发生装置最好选用 (选填装置编号)。请写出生石灰在此反应中的两个作用: , 。
(2)干燥氨气可以将气体通过装有 (填化学式)的装置D。
(3)兴趣小组计划用E装置收氨气,简述判断氨气已经集满的方法。 。
(4)按图连接仪器后,计划在纯净水塑料瓶内引发喷泉,你会采取怎样的操作? 。
⑸ 试验后为处理纯净水塑料瓶内存在的氨水(NH3•H2O)可以加入少量稀硫酸,发生反应的化学方程式为 。
比较和归纳是学习化学的常用方法。某学习小组的同学在下图所列出的实验装置的基础上进行了学习。
(1)若用B、F组成制取某气体的装置,写出制取此气体的化学方程式为 ,可用B装置还可制取另一气体,写出发生装置中的化学方程式是 。
(2)乙炔(C2H2)是无色、无味、易燃的气体,乙炔的密度比空气略小,微溶于水。乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体)与水反应生成,同时生成一种白色固体。已知碳化钙与水反应非常剧烈。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 。
(3)如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
①写出B中反应的化学方程式: 。
②要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是 (填序号)。
联合钢铁工业的基本生产流程示意图如下:
请回答下列问题:
(1)写出设备A 的名称: ;产品B和C 分别是 和 。
(2)写出以赤铁矿为原料在高温下与一氧化碳反应制取铁的化学方程式: ;
(3)应用化学原理分析,工业炼钢时用纯氧而不用空气的原因是: 。
如图所示,在托盘天平两边各放一只烧杯,调至平衡。往右边烧杯里注入一定量的稀硫酸,左边烧杯里注入相同质量的盐酸。
(1)两边烧杯中各投入少量相同质量的锌粒,锌粒完全溶解后,天平指针有何变化? 为什么?
(2)若左边投入锌粒,右边投相同质量的镁条,锌、镁全部溶解后,天平指针有何变化? , 为什么? 。
将X溶液逐滴滴入Y溶液中,在滴加过程中,Y溶液的pH变化情况如图所示。
| 溶液 |
A组 |
B组 |
C组 |
D组 |
| X |
盐酸 |
盐酸 |
氢氧化钙 |
氢氧化钙 |
| Y |
氢氧化钙 |
水 |
盐酸 |
水 |
(1)表格中符合这种变化情况的是 组(填写编号),理由是
(2)处于图中m点时,溶液中的溶质为 。
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线回答下列问题: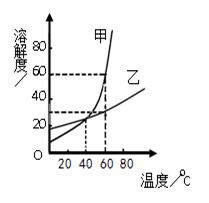
(1)溶解度的单位是 ;
(2)在 温度范围内,乙物质的溶解度大于甲物质的溶解度;
(3)20℃将30g甲物质溶解于50g水中,得到的是 (填“饱和”或“不饱和”)溶液
(4)60℃时,乙物质的饱和溶液的质量分数为 ;(用分数表示,不用化为小数)
(5)40℃时,甲乙两物质的溶解度相等,有关这两种物质饱和溶液的性质描述一定正确的是 。(选填编号)
| A.溶液质量一定相等 |
| B.溶液的密度一定相等 |
| C.溶液的质量分数一定相等 |
| D.如果降温到 20℃,甲、乙两溶液的质量分数仍然相等 |
对比学习有利于发现事物的共性与个性。为探究酸的化学性质,同学们进行了如下实验。
| 实验内容 |
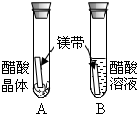 |
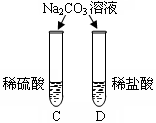 |
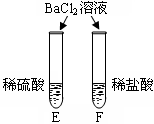 |
| 实验现象 |
A试管内无明显现象,B试管中镁带表面观察到的现象是 。 |
C、D两试管中均观察到有气泡产生。 |
E试管中观察到的现象是 ; F试管中无明显现象。 |
| 结论 |
酸的很多反应通常在水溶液中才能完成。 |
不同的酸具有相似的化学性质。 |
不同的酸根会导致酸的“个性”有差异。 |
请分析上述现象并回答:
(1)不同的酸具有相似的化学性质,这是因为酸的组成中都含有 (填元素符号)。
(2)不同的酸根会导致酸的“个性”有差异,因此,可用 鉴别盐酸和硫酸。
(3)清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为 ,白色沉淀中可能还含有 (填化学式)。
如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。
根据图示回答:
(1)P点的含义是 。
(2)在不改变溶液的溶质质量分数的情况下,把c物质的不饱和溶液变成饱和溶液的方法是 。
(3)t2℃时40g a物质加入到60g水中不断搅拌,溶液质量为 g。
(4)将t1℃a、b、c三种物质饱和溶液升温至t2℃时,三种溶液的溶质质量分数大小关系是 (填选项序号)。
Ⅰ.a>b=c Ⅱ.a=b>c Ⅲ.a>b>c Ⅳ.b > a >c
如图为NaCl、KNO3的溶解度曲线。
(1)20℃时,NaCl的溶解度是 。
(2)20℃时,将20gNaCl固体投入到50g水中,得到的是NaCl的 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量分数是 (保留到0.1%)。
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、蒸发浓缩、 ,然后过滤、洗涤、干燥。
(4)某同学在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是 
| A.向④加入4.5gKNO3即可达到饱和 | B.②③⑤中溶质的质量分数相等 |
| C.①③④均为KNO3的不饱和溶液 | D.④→⑤可析出53.9gKNO3晶体 |
以下实验装置可进行气体制备、收集及分离实验。请回答有关问题:

(1)仪器①的名称是 ,仪器②的作用是 。
(2)用氯酸钾与二氧化锰混合制取氧气,选择的发生装置是 (填编号),反应的化学方程式为 。
(3)通过装置F(其中液体药品均足量)可以将二氧化碳和一氧化碳的混合气体进行分离。首先打开活塞a,广口瓶中观察到的现象是 ,此时从导管c逸出的气体主要是 。一段时间后,关闭活塞a,打开活塞b,滴加足量的稀盐酸,此时逸出的气体主要是 ,发生反应的化学方程式为 。
试题篮
()