已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,
③2FeCl3+2KI==2FeCl2+2KCl+I2,④2FeCl2+Cl2==2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是
| A.ClO3->BrO3->Cl2>Fe3+>I2 | B.BrO3->Cl2>ClO3->I2>Fe3+ |
| C.BrO3->ClO3->Cl2>Fe3+>I2 | D.BrO3->ClO3->Fe3+ >Cl2>I2 |
根据下列化学方程式,判断有关物质的还原性强弱顺序正确的是( )
①I2+SO2+2H2O=H2SO4+2HI;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
已知氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,且下列反应均可发生:(1)H2S+I2=2H++2I—+S¯ (2)H2SO3+2H2S=3S¯+3H2O (3)2I—+Br2=2Br—+I2
(4)H2SO3+I2+H2O=H2SO4+2HI 。则Br—、I—、H2S和H2SO3还原性由强到弱的顺序是( )
| A.H2S>H2SO3>I—>Br— | B.Br—>I—>H2SO3>H2S |
| C.H2SO3>H2S>Br—>I— | D.I—>Br—>H2S>H2SO3 |
在一定条件下,RO3-与R-发生反应:RO3-+5R-+6H+=3R2+3H2O。Q元素与R元素同族,且均为短周期元素。下列说法正确的是
| A.R.Q是VA族元素 |
| B.R的氢化物稳定性大于Q的氢化物的稳定性 |
| C.氧化产物和还原产物的质量比之为1:5 |
| D.R的最高价氧化物的水化物的酸性强于H2SO4 |
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :
已知,Fe2+结合S2—的能力大于结合OH—的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A.FeS、Al(OH)3和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 | D.Al2S3、FeS和S |
在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.2Fe2++Cl2=2Fe3++2Cl- |
| C.2Br-+4H++SO42-=SO2+Br2+2H2O |
| D.I2+SO2+2H2O=4H++SO42-+2I- |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
铜、铁、锌等质量合成的合金W g,加入FeCl3和盐酸的混合液中,充分反应后: (1)若无固体剩余,则溶液中的阳离子一定有 ,还可能有 。
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有 ,可能还有 。一定没有 。
(3)若剩余固体为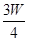 g,则溶液中的阳离子一定有 ,一定没有 .
g,则溶液中的阳离子一定有 ,一定没有 .
下述实验不能达到预期目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
验证Ksp(AgCl)>Ksp(AgI) |
向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B |
检验Fe(NO3)2晶体是否已氧化变质 |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C |
验证Br2的氧化性强于I2 |
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D |
比较确定铜和镁的金属活动性强弱 |
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II .(4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
常温下,分别在溶液中发生如下反应:(1)16H+ + 10Z- + 2XO4- ="=" 2X2++ 5Z2↑+ 8H2O,
(2)2A 2+ + B2==2A3++ 2B-,(3)2B- + Z2== B2 + 2Z-。由此判断下列说法错误的是( )
| A.反应Z2+2A 2+="=" 2A3++2Z-能发生 |
| B.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| C.还原性由强到弱的顺序是 A 2+、B-、Z-、X2+ |
| D.Z元素在(1)、(3)反应中均被还原 |
试题篮
()