已知下列几个反应的化学方程式:
① 2H2S + SO2 =" 3S↓+" 2H2O
② 2KI + Cl2 =" 2KCl" + I2
③ 2FeCl2 + Cl2 = 2FeCl3
④ 2FeCl3 + 2HI =2FeCl2 + I2 + 2HCl
⑤ I2 + SO2 + 2H2O = H2SO4+ 2HI
下列有关物质的氧化性的强弱排列顺序中正确的是
| A.Cl2>Fe3+>I2>SO2 | B.Cl2 >I2>Fe3+>SO2 |
| C.Cl2>Fe3+>SO2>I2 | D.Fe3+>I2>Cl2 >SO2 |
已知反应:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(浓)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列说法正确的是 ( )
| A.上述3个反应都是置换反应 |
| B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 |
| C.反应②中若得到6.72 L Cl2(标准状况),则电子转移个数为3.01×1023 |
| D.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol |
下列反应既属于化合 反应,又属于氧化还原反应的是
反应,又属于氧化还原反应的是
| A.Fe +HCl =H2+FeCl2 | B.2FeCl2+ Cl2=2FeCl3 |
| C.CaO + H2O = Ca(OH)2 | D.2Fe(OH)3= Fe2O3+ 3H2O |
为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是
| A.NaIO3是氧化剂,HSO3-是还原剂 |
| B.生产中可得到副产物H2SO4和Na2SO4 |
| C.I2既是氧化产物又是还原产物 |
| D.HSO3-的还原性比I- 弱 |
根据下列事实,判断离子的氧化性顺序为
①A+B2+=A2++B ②D+2H2O=D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B=B2+ +2e-
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :
已知,Fe2+结合S2—的能力大于结合OH—的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A.FeS、Al(OH)3和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 | D.Al2S3、FeS和S |
在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.2Fe2++Cl2=2Fe3++2Cl- |
| C.2Br-+4H++SO42-=SO2+Br2+2H2O |
| D.I2+SO2+2H2O=4H++SO42-+2I- |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
铜、铁、锌等质量合成的合金W g,加入FeCl3和盐酸的混合液中,充分反应后: (1)若无固体剩余,则溶液中的阳离子一定有 ,还可能有 。
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有 ,可能还有 。一定没有 。
(3)若剩余固体为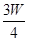 g,则溶液中的阳离子一定有 ,一定没有 .
g,则溶液中的阳离子一定有 ,一定没有 .
下述实验不能达到预期目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
验证Ksp(AgCl)>Ksp(AgI) |
向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B |
检验Fe(NO3)2晶体是否已氧化变质 |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C |
验证Br2的氧化性强于I2 |
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D |
比较确定铜和镁的金属活动性强弱 |
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II .(4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中 通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是( )
通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化 ②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化 ③不 能确定通入氯气后的溶液中
能确定通入氯气后的溶液中 是否存在Fe2+ ④若取少量所得溶液,再加入CCl4溶液
是否存在Fe2+ ④若取少量所得溶液,再加入CCl4溶液 ,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生
,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生 白色沉淀,说明原溶液中的I-、F
白色沉淀,说明原溶液中的I-、F e2+、Br-均被完全氧化
e2+、Br-均被完全氧化
| A. ①②③ | B.②③④ | C.①③④ | D.①②③④ |
试题篮
()